Dit artikel is een samenvatting van ‘Development of a targeted mass-spectrometry serum assay to quantify M-protein in the presence of therapeutic monoclonal antibodies’ van Zajec et al., gepubliceerd in J Proteome Res 2018 Mar 2;17(3):1326-1333.
Inleiding
Verbeterde behandeling bij multipel myeloom (MM) leidt tot een groter aantal patiënten dat volledige remissie bereikt, waarbij geen resterende tumorbelasting wordt gedetecteerd. De meeste patiënten krijgen uiteindelijk toch weer ziekteverschijnselen, aangezien een klein aantal kankercellen zelfs tijdens volledige remissie overblijft; deze toestand wordt minimale restziekte (MRD) genoemd. M-proteïne is een MM-biomarker die uniek is voor iedere patiënt. M-proteïne kan worden gebruikt als een marker voor gepersonaliseerde kankerdiagnostiek en is bruikbaar voor monitoring (1,2)
De huidige technieken voor het detecteren van M-proteïne in klinische laboratoria zijn serumeiwitelektroforese (SPE) en immunofixatie-elektroforese (IFE). Deze technieken hebben een relatief lage gevoeligheid en kunnen vaak geen onderscheid maken tussen M-proteïne en therapeutische monoklonale antilichamen (mAbs) in serum (3,4). Gevoeligere technieken om MRD te detecteren zijn gebaseerd op plasmacelonderzoek in het beenmerg. Deze technieken, bijvoorbeeld flowcytometrie, allelspecifieke oligonucleotide polymerasekettingreactie (ASO-PCR) en next generation sequencing (NGS) worden uitgevoerd op invasief verkregen beenmergaspiraten en biopten (5,6).
We hebben een massaspectrometrie (MS)-test ontwikkeld om M-proteïne te detecteren in serum van patiënten in de aanwezigheid van therapeutische mAbs die verstorend kunnen werken in SPE en IFE.
Methode
Serum van een MM-patiënt van wie een beenmergmonster en Sanger sequentiegegevens beschikbaar waren, werd gekozen om de gevoeligheid van de test te bepalen. Voor het M-proteïne van de patiënt werden twee referentiepeptiden geselecteerd, NSLSLQMNNLR (NSL) en GLEWVSAISGSGGTYYADSVK (GLE), en overeenkomstige stabiele isotoopgemerkte (SIL) peptiden werden gebruikt voor kwantificatie. Om de MRD na te bootsen, werd een verdunningsreeks bereid door het MM-patiëntserum te verdunnen met serum van een gezond individu tezamen met SIL-peptiden en therapeutische mAbs: daratumumab, nivolumab en ipilimumab.
Serummonsters werden direct gebruikt voor digestie en metingen. Bovendien werd serumimmunoglobuline (Ig) gezuiverd met Melon-gel (Pierce, Rockford, IL), gedigesteerd met trypsine en vervolgens gemeten met een Orbitrap Fusion Lumos Tribrid massaspectrometer (Thermo Fisher Scientific, San Jose, CA).
De data werden geanalyseerd met behulp van Skyline (7). De concentratie van elk peptide werd berekend uit de piekoppervlakverhouding tussen de endogene en de SIL-peptiden (referentiepeptiden).
Drie onafhankelijke runs van Melon-gezuiverde Ig-verdunningsreeksen werden gemeten. De gevoeligheid werd bepaald voor elk peptide. Limit of detection (LOD) werd gedefinieerd als (3,3 x SDcontroleserum)/helling, en lower limit of quantification (LLoQ) werd gedefinieerd als 3 x LOD, volgens de ICH-richtlijnen (8).
SPE-, IFEen vrije-lichteketen (FLC)-analyse werden uitgevoerd om het verschil in gevoeligheid tussen conventionele M-proteïnediagnostiek en de MS-test aan te tonen. SPE en IFE werden uitgevoerd op een Hydrasys-apparaat (Sebia, Evry, Frankrijk) met behulp van reagentia van Sebia. Serum FLC-analyse werd uitgevoerd met behulp van de Freelite FLC-test (The Binding Site, Birmingham, Verenigd Koninkrijk) op een BNII-analysator (Siemens, Marburg, Duitsland). De SPE-, IFEen FLC-test werden allemaal uitgevoerd volgens de protocollen van de fabrikant. MM-serumverdunningsreeksen in de controleserummatrix werden bereid en geanalyseerd. SPE, IFE, en de FLC-bepaling werden uitgevoerd zonder toevoeging van therapeutische mAbs vanwege de boven genoemde interferentie.
Resultaten
De M-proteïneconcentratie in het onverdunde MM-serum werd met SPE vastgesteld op 16,6 g/l. Het M-proteïne werd gekenmerkt door de IFE-analyse als IgG met een kappa-lichte keten (IgG-K). In 125 keer verdund MM-serum (130 mg M-proteïne/l) is het M-proteïne niet langer detecteerbaar met SPE en IFE. Ook normaliseert de FLC-verhouding tot niet-detecteerbaar M-eiwit in het 125 keer verdunde serum.
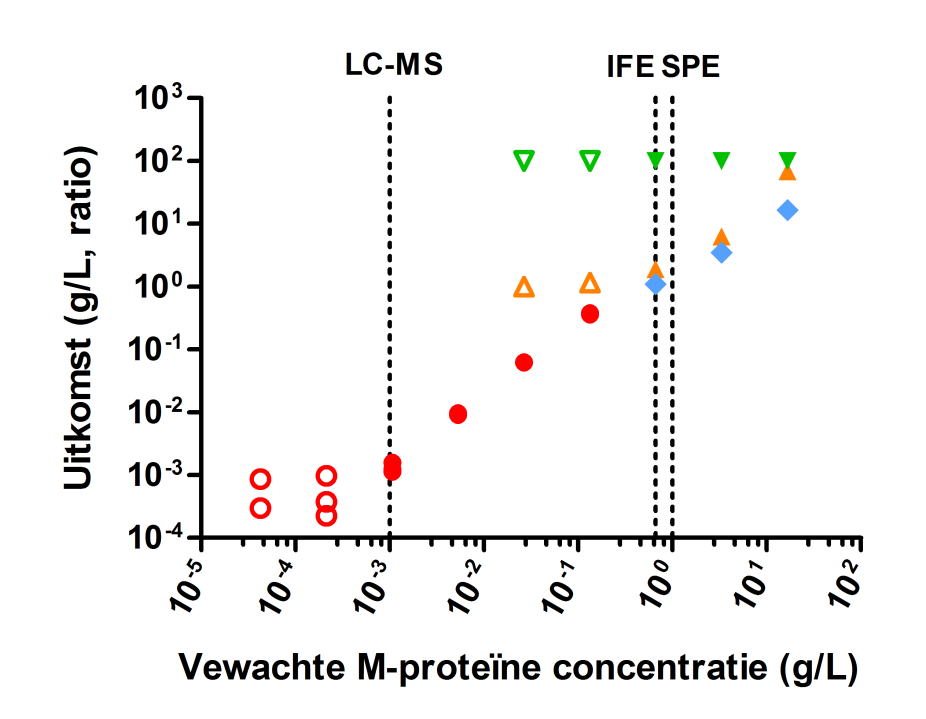
Met de MS-test is het M-proteïne nog detecteerbaar in 15.625 keer verdund MM-serum (1 mg/l van het M-proteïne) in de aanwezigheid van therapeutische mAbs. De twee referentiepeptiden voor het M-eiwit vertonen verschillende gevoeligheid (zie Tabel 1). Voor beide proteotypische peptiden van het M-proteïne was de detectie en kwantificering in met Melon-gel gezuiverde Ig echter gevoeliger dan in serum. Voor het gevoeligere peptide, GLE, is de LOD van de MS-test 0,2 mg/l en de LLoQ is 0,7 mg/l. De ontwikkelde MS-test kan zich richten op M-proteïne in de aanwezigheid van therapeutische mAbs en is meer dan twee ordes van grootte gevoeliger dan conventionele M-proteïneanalyse (zie Figuur 1).

Discussie
We hebben de haalbaarheid aangetoond voor het detecteren en kwantificeren van M-proteïne in serum van een MM-patiënt in de aanwezigheid van drie verschillende therapeutische mAbs. Als meerdere therapeutische mAbs aan een patiënt worden toegediend, worden SPEen IFE-patronen moeilijk te interpreteren en is beoordeling van de aanwezigheid van M-proteïne niet meer mogelijk. Deze MS-test omzeilt de interferentie die afkomstig is van toegediende mAbs, omdat het zich richt op peptiden uit de variabele gebieden van immunoglobulinen.
Metingen van M-proteïneverdunningen in een controleserum tonen twee ordes van grootte verschil in gevoeligheid in het voordeel van MS versus conventionele M-proteïnediagnostiek. Detectie van het M-proteïne was gevoeliger nadat immunoglobulines door Melon extractie uit serum waren verrijkt. Dit heeft betrekking op de vermindering van de complexiteit van de serummatrix na immunoglobulineverrijking, die iononderdrukking vermindert en de introductie van een verhoogde hoeveelheid immunoglobulines in de massaspectrometer mogelijk maakt. Omdat de huidige M-proteïnediagnostiek op serummonsters (SPE, IFE en FLC-analyse) een beperkte gevoeligheid heeft, zou de follow-up van de patiënt baat hebben bij gevoeligere assays die MRD-beoordeling mogelijk maken.
Standaardisatie van gerichte MS-tests in meerdere laboratoria is mogelijk door het gebruik van SIL-peptiden als interne standaard (9). Het gebruik van SIL-peptiden verhoogt de gevoeligheid en betrouwbaarheid, vooral bij lagere M-proteïneconcentraties. De kwantificatie van M-proteïne moet betrouwbaar zijn bij diagnose, wanneer de tumorbelasting en de concentratie van het M-proteïne hoog zijn, maar ook bij MRD, wanneer de concentratie van het M-proteïne erg laag is. De SIL-peptiden werden aan de monsters toegevoegd voorafgaand aan de digestie, omdat SIL-peptiden corrigeren voor experimentele en instrumentele variabiliteit en voor mogelijk verlies van het endogene peptide veroorzaakt door monsterbereiding of peptideadsorptie op oppervlakken.
Een serummonsterafname is minder invasief dan een beenmergbiopsie, en voor het comfort van de patiënt is een op serum gebaseerde test dan ook een wenselijk alternatief voor het monitoren van de ziekte. Bovendien geven op beenmerg gebaseerde benaderingen een risico op steekproeffouten die voortkomen uit tumorheterogeniteit in het beenmerg.
Conclusie
De ontwikkelde MS-assay op serum kan herhaalde beenmergaspiraties voorkomen, maakt absolute kwantificering van M-proteïne mogelijk in de aanwezigheid van therapeutische monoklonale antilichamen en is meer dan twee ordes van grootte gevoeliger dan conventionele M-proteïnediagnostiek.