Casus
We beschrijven hier een vrouwelijke, à terme-geboren neonaat van consanguïne ouders die zich zes uur na geboorte presenteerde met geelzucht. Omdat bekend was dat ze mogelijk drager was van een familiaire, maar nog niet nader gespecificeerde erythrocytaire glutathionsynthesestoornis, werd ze naar de kinderafdeling van Gelre ziekenhuizen in Apeldoorn gebracht. Daar werd laboratoriumonderzoek aangevraagd en werden bloedmonsters afgenomen en geanalyseerd op het klinisch chemisch laboratorium in Apeldoorn. Analyse van het bloedmonster liet hyperbilirubinemie (bilirubine: 216 mmol/L; ref: < 100 mmol/L), verhoogde hemolyse parameters (LD: 887 U/L; ref: < 250 U/L; haptoglobine: 0,08 g/L; ref: 0,4 – 2,0 g/L; reticulocyten: 443 /nL; ref: 25 – 110 /nL; negatieve directe Coombs en leukocytose zien (35,3 / nL; ref. 10,0 – 26,0 /nL) met een linksverschuiving. Door de mogelijke aanwezigheid van een erfelijke glutathionsynthesestoornis werd de neonaat direct behandeld met fototherapie, werd antibiotica gegeven en een wisseltransfusie toegepast. De behandeling was succesvol en de neonaat herstelde volledig.
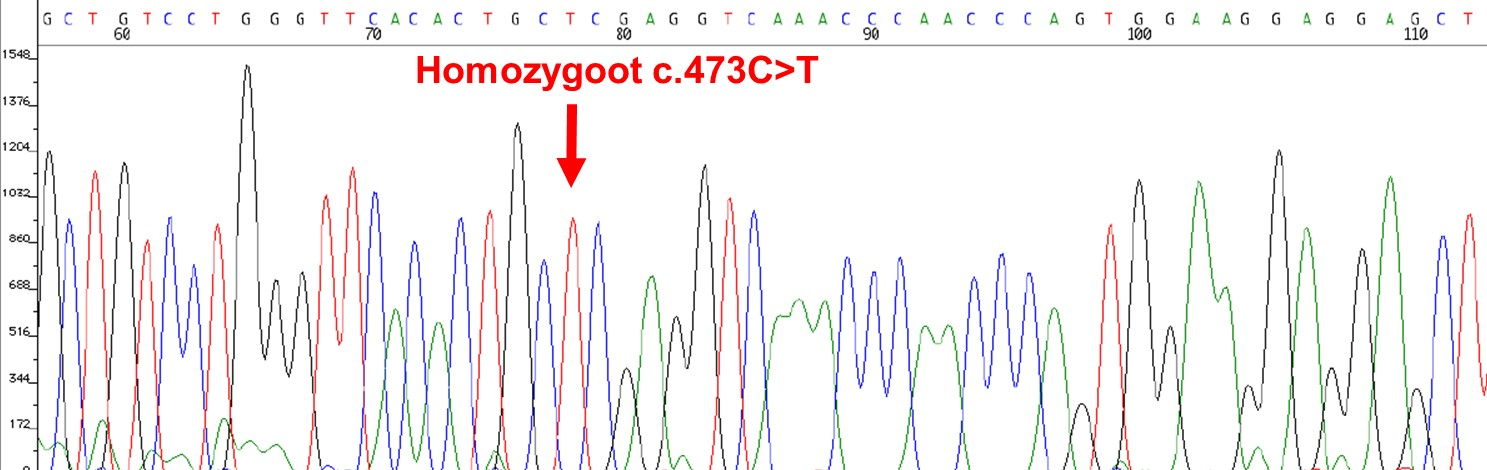
Vervolgonderzoek naar de erytrocytaire enzymafwijking werd ingezet met de bloedmonsters die waren afgenomen voorafgaand aan de wisseltransfusie. In het specialistische Rode Bloedcel Laboratorium van het UMC Utrecht werd het vervolgonderzoek gestart: een gluthation-instabiliteitstest werd ingezet waarin de concentratie gluthation werd gemeten voor en na toevoeging van phenylhydrazine, dat oxidatieve stress induceert. De reductie in glutathionconcentratie na toepassing van de oxidatieve stress in de erytrocyten van de neonaat was normaal ten opzichte van een controle monster (31 %; ref: 22 %). Maar de basale concentratie gluthation was sterk verlaagd (0,65 mmol gluthation/ml erythrocyten; REF: 1,5-2,9 mmol GSH/ml), hetgeen zeer suggestief is voor een defect in glutathionsynthese. DNA-onderzoek naar de genen in deze pathway werd vervolgens ingezet om dit te bevestigen. DNA-analyse liet een homozygote c.473C>T p. (Pro158Leu) mutatie zien op het GCLC-gen dat codeert voor de katalytische subunit van het enzym glutamaatcysteïneligase (met als oude naam: g-glutamylcysteïnesynthase) (zie figuur 1), dat resulteert in glutamaatcysteïneligase-deficiëntie (1).
Bespreking
Om goed te kunnen functioneren zijn erytrocyten grotendeels afhankelijk van de anaerobe conversie van glucose door de 'Embden-Meyerhof pathway' (EMP) en de 'Hexose-monophosphate pathway' (HMP), getoond in figuur 2. Glucosekatabolisme via de HMP wordt verhoogd door oxidatieve stress, bijvoorbeeld wanneer er sprake is van een infectie of bij gebruik van bepaalde geneesmiddelen. HMP genereert NADPH dat nodig is voor de reductie van geoxideerd glutathion door glutathionreductase. De eerste stap van de glutathionsynthese wordt gekatalyseerd door glutamaatcysteïneligase. Gereduceerd glutathion beschermt hemoglobine en andere belangrijke erytrocyt-eiwitten tegen peroxidative schade (2,3).
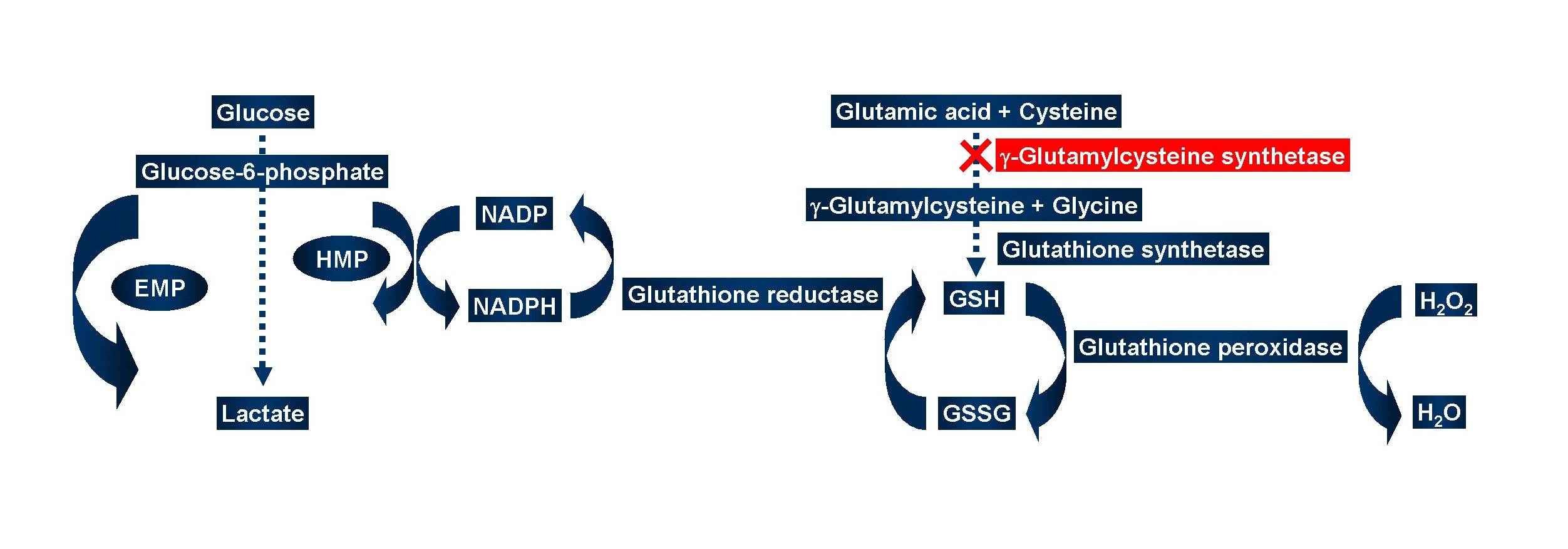
In de beschreven casus is er een deficiëntie van glutamaatcysteïneligase. Dit resulteert in een verlaagde hoeveelheid gereduceerd glutathion, hetgeen onder invloed van een bacteriële infectie resulteert in de gevonden hemolyse en de hyperbilirubinemie.
Vervolg
Familiaire glutamaatcysteïneligase-deficiëntie is een zeer zeldzame aandoening. Bij deze patiënten leidt dit tot een chronische normocytaire hemolytische anemie. Het is beschreven dat infecties en toxische stoffen (drugs, geneesmiddelen) kunnen leiden tot hemolytische perioden (4,5). In de literatuur zijn slechts enkele patiënten beschreven en de eerste patiënt werd ongeveer 20 jaar geleden beschreven door Beutler (2). De in deze casus beschreven familie is waarschijnlijk verwant aan twee families beschreven door Kamerbeek in 2007 (6). De mutatie (Pro158Leu-mutatie) die hier gevonden is, werd ook beschreven door Ristoff (1). Wel zijn alle in de literatuur beschreven patiënten uit vier niet-verwante verschillende families gediagnosticeerd op oudere leeftijd (vaak na een hemolytische periode) (7). Bij deze neonaat wijst de linksverschuiving op een bacteriële infectie als de trigger en bron voor de oxidatieve stress die resulteert in de gevonden hemolyse en hyperbilirubinemie. Momenteel maakt de patiënte het nog steeds goed. De patiënte moet wel levenslang bedacht blijven op medicatie (bepaalde antibiotica, antimalaria en analgetica) en/of voeding (zoals tuinbonen) die kunnen leiden tot oxidatieve stress, wat in haar geval zal leiden tot hemolyse.