Samenvatting
Het Sperm Class Analysis (SCA)® Evolution systeem van Microptic werd geverifieerd voor toepassing bij semenbewerkingen. De within en intermediate precisie zijn vastgesteld door middel van metingen in bead-suspensies en bleken met respectievelijk maximaal 8,6% en 11,6% acceptabel. Precisieprofielen voor concentratiemetingen en motiliteitsbeoordelingen in semenmonsters lieten een maximale variatiecoëfficient van respectievelijk 17,1% en 21,7% zien. In bewerkt semen was sprake van zeer goed overeenkomende resultaten voor VCM (r= 0,99) met gemiddeld 6% lagere uitkomsten voor de SCA®. Het methodevergelijk in onbewerkt semen liet consistent lager gemeten percentages progressief motiele cellen (-48%) en daarmee ook lagere VCM-waarden (-40%) door de SCA® zien. Aanvullend onderzoek toonde overdetectie van immotiele zaadcellen door interferentie van niet-zaadcel deeltjes. Een goede evaluatie van de SCA®-resultaten en correct gebruik van het intelligent-filter resulteerde in beter overeenkomende resultaten. Op basis van de bevindingen is de SCA® in ons laboratorium in gebruik genomen voor de analyse van bewerkt semen.
Inleiding
In ons ziekenhuis is het aantal intra-uteriene inseminatie (IUI)s de afgelopen jaren sterk gestegen. Om aan de toegenomen vraag voor semenbewerking te kunnen voldoen, worden daarom frequent meerdere semenmonsters simultaan in het fertiliteitslaboratorium bewerkt. Het ontvangen, bewerken en uitleveren van semen is een risicovol laboratoriumproces, vooral als meerdere semenmonsters gelijktijdig op het laboratorium aanwezig zijn. Concentratievermindering door werkdruk bij de analist bleek bij risicoanalyse een factor met een relatief hoog risico. Hierbij worden door analisten vooral de microscopische semenanalyses voor en na de semenbewerking als arbeidsintensief ervaren.
Computergeassisteerde semenanalyse (CASA)-systemen zijn in de afgelopen decennia op de markt verschenen en worden tot op heden verder ontwikkeld en geoptimaliseerd (1-3). Mits gevalideerd of geverifieerd en toegepast voor het beoogde doel, biedt CASA voordelen vanwege gebruiksvriendelijke, snelle en reproduceerbare semenanalyses. CASA levert tevens mogelijk waardevolle kwantitatieve aanvullende parameters op die met de manuele methode niet verkregen kunnen worden. Daarnaast kan, afhankelijk van het systeem, in min of meerdere mate informatie opgeslagen en teruggekeken worden (4). In ons laboratorium werd voor analyse van kwalitatief goede semenmonsters al geruime tijd CASA toegepast met behulp van het Spermalite (Sperm Quality Analyzer (SQA)-V)-systeem ( Medical Electronic Systems). Omdat dit inmiddels verouderde systeem vanwege een te groot benodigd testvolume (250 µl) niet geschikt was voor een eventuele toepassing bij semenbewerking, is gezocht naar een alternatief. Wij beschrijven hier onze ervaringen tijdens de verificatie van het Sperm Class Analysis (SCA)® Evolution systeem van Microptic voor een mogelijke toepassing bij semenbewerking.
Materiaal en methoden
Patiënt- en kwaliteitscontrolematerialen
Bij deze verificatie is gebruikgemaakt van restanten van semenmonsters die aangeboden werden voor semenanalyse of semenbewerking en waarbij geen sprake was van bezwaar tegen nader gebruik van lichaamsmateriaal. Daarnaast zijn voor precisie experimenten QwikCheck™ Beads (QCB, Medical Electronic Systems) gebruikt.
Manuele en computer geassisteerde semenanalyse
Manuele semenanalyses zijn volgens onze reguliere procedure uitgevoerd door goed getrainde analisten. Hierbij wordt gewerkt volgens de richtlijn semenanalyse (5) en de in 2010 gepubliceerde handleiding van de Wereldgezondheidsorganisatie (WHO) (6). Voor de motiliteitsclassificatie wordt nog de WHO 1999 handleiding (7) aangehouden. Alle analyses werden gedaan op een verwarmde microscooptafel (37°C). De concentratie werd vastgesteld door duplotellingen in disposable Bürker-Türk-telkamers met 10 μl telvolume. De motiliteit van 2 x 100 cellen werd beoordeeld in een nat 10 μl preparaat met 24 x 24 mm dekglaasje en werd gescoord in vier klassen: Klasse A: snel , progressief bewegend (> 25 μm/sec); klasse B: langzaam, progressief bewegend (> 5 μm/sec, < 25 μm/sec); klasse C: niet progressief op de plaats bewegend (> 0 μm/sec, < 5 μm/sec); klasse D: niet bewegend. Berekende parameters betroffen het percentage progressief beweeglijke zaadcellen (klasse A + B) en VCM ( = volume x concentratie x (klasse A + B)/100).
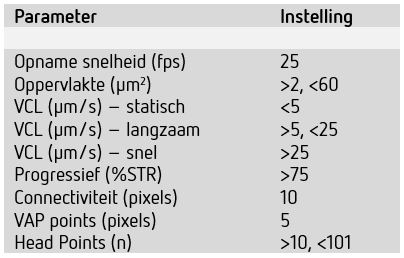
VCL: curvilinear velocity, STR: straightness, VAP: average path velocity, fps: frames per seconde.
Twee microscopen die ook gebruikt worden voor de manuele semenanalyse zijn via een trinoculair uitgerust met een digitale camera en gekoppeld aan de analyse software (v. 6.3) van het Microptic SCA® Evolution systeem (Gynotec, Malden, Nederland). De SCA® maakt gebruik van positieve fase-contrast video-opnames van één seconde met een standaard opnamesnelheid van 25 frames per seconde. Verschillende configuraties voor diverse preparaattypes zijn aangemaakt, waarbij constante definities en restricties voor herkenning van zaadcellen en classificatie van beweeglijkheid zijn gehanteerd (zie Tabel 1). Definities voor motiliteitclassificaties kwamen overeen met die voor de manuele semenanalyse. De SCA® geeft zelf aan wanneer een verdunning gemaakt dient te worden (concentratie > 100*106/ml). De gemaakte videobeelden en analyses werden beoordeeld door de analist, waarbij beeldvelden met afwijkende elementen zoals debris of aggregaten aangemerkt en buiten de analyse gehouden konden worden. Naar eigen inzicht van de analisten werd het intelligent-filter toegepast. Dit betreft een filter met stringentere detectie-instellingen waardoor een automatische correctie wordt uitgevoerd op alle videobeelden en debris beter buiten de analyse gehouden kan worden. De resultaten worden inclusief alle videobeelden en informatie per gedetecteerde zaadcel opgeslagen, en kunnen naderhand bekeken worden.
Preparaten
Na een training en een maand familiarisatie is eerst vastgesteld met welk type preparaat CASA in ons laboratorium de beste resultaten geeft. In semenmonsters (n = 18) zijn CASAs met twee type preparaten uitgevoerd die beide werden vergeleken met de uitkomsten van manuele semenanalyse. Op advies van de leverancier werd gewerkt met disposable Leja-telkamers met 12 μ m diepte (Leja-12, Leja Products, Nieuw-Vennep, Nederland) en het natte preparaat zoals beschreven voor onze manuele methode. De Leja-12-telkamers werden gevuld met 4 μl semen. De uitkomsten voor concentratie, beweeglijkheid en VCM verkregen met de SCA® werden vergeleken met de manuele methode. Daarnaast zijn de resultaten voor concentratie- en motiliteitsmetingen van de individuele videobeeldanalyses (n = 10) binnen elk preparaat getoetst op variatie. Op basis van de bevindingen bij een interim-analyse is het vervolgonderzoek uitgevoerd in de Leja-12-telkamers.
Precisie
De herhaalbaarheid van concentratiemetingen is voor twee SCA®s vastgesteld door tienvoudige metingen in twee concentraties van QCB-suspensies. Het acceptatiecriterium werd gesteld op een maximale variatiecoëfficiënt (VC) van 10%. De intermediate precisie van concentratiemetingen is voor beide systemen bepaald door gedurende tien dagen de QCB-suspensies in tweevoud te meten. Als acceptatiecriterium werd maximaal 20% variatie gesteld.
Herhaalbaarheidsprofielen voor concentratiemetingen en motiliteitsanalyses in verse semenmonsters zijn geconstrueerd door in 24 kwalitatief verschillende semenmonsters vijfvoudige CASAs in hetzelfde preparaat uit te voeren. Voor de motiliteitsanalyse werden steeds tenminste tweehonderd cellen geanalyseerd. Als acceptatiecriterium werd voor beide parameters een maximale variatiecoëfficiënt van 20% gesteld.
Juistheid
Na een definitieve keuze voor de Leja-12-telkamer is de juistheid van CASA-meetresultaten verder in kaart gebracht door vergelijkend onderzoek in een groter aantal patiënten monsters. In totaal zijn 64 patiëntmaterialen geanalyseerd waarvan 22 monsters ook als bewerkt (met gradiëntmethode) monster. Het klinisch beleid met betrekking tot fertiliteitsbehandelingen wordt in ons ziekenhuis gebaseerd op VCM-waarden voor zowel onbewerkt als bewerkt semen. Een overzicht van de medische beslisgrenzen en het daarop gebaseerd medisch beleid staat vermeld in tabel 2. Als acceptatiecriterium voor juistheid werd gesteld dat CASA niet tot significante verschillen in het klinische relevante gebied voor VCM-waarden mocht leiden.

Statistische analyse
Statistische analyses zijn uitgevoerd m.b.v. Excel en Analyse-it ® v 5.61 (Analyse-it Software, Ltd). Verdelingen van data werd getoetst m.b.v. boxplot analyses en Shapiro-Wilk tests, statistische verschillen werden afhankelijk van de verdeling van data onderzocht met Student’s-t of Wilcoxon-Mann-Whitney tests. Methodeverschillen werden getoetst d.m.v. Passing-Bablok en Bland-Altman limit of agreement analyses.
Resultaten
Onderling vergelijk SCA®s
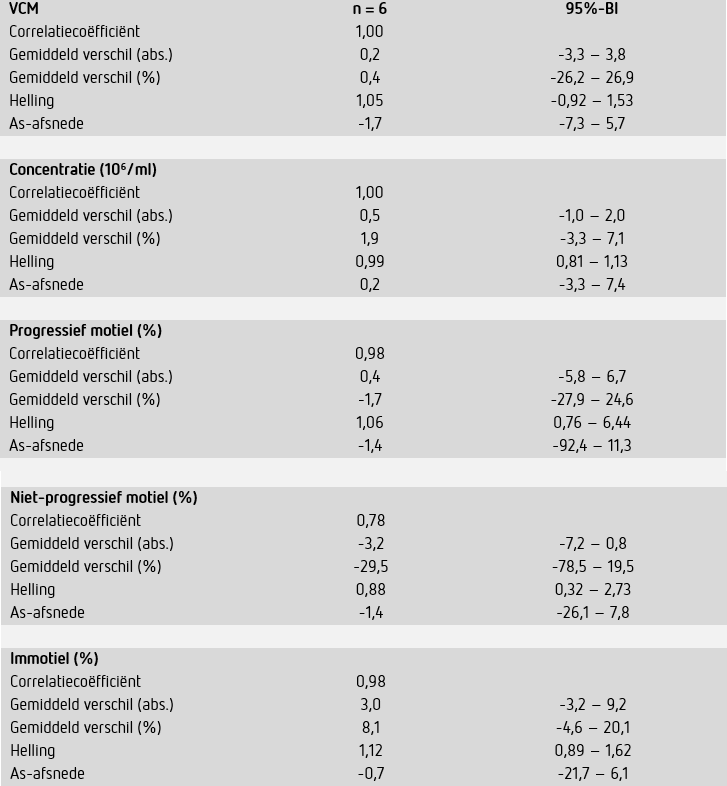
In deze verificatie zijn resultaten verkregen met twee SCA®s. Vergelijkbaarheid van de gebruikte systemen werd vastgesteld door een vergelijkend onderzoek waarbij preparaten (n = 6) verspreid over een breed meetbereik kort na elkaar door beide systemen zijn geanalyseerd. De correlaties voor concentratiemetingen (r = 1,00), classificatie van progressief motiele cellen (r = 0,98) en VCM (r = 1,00) bleken zeer goed (tabel 3).
CASAs vs. manuele beoordeling in verschillende preparaten
Uitkomsten van CASA uitgevoerd met de Leja-12-telkamer lieten betere correlaties met de manuele methode zien dan CASA uitgevoerd met het natte preparaat (tabel 4). Met name concentratiemetingen door de SCA® kwamen in de Leja-12-telkamer zeer goed overeen. Wel viel op dat bij CASA met de Leja-12-telkamer lagere percentages progressief motiele zaadcellen en meer immotiele zaadcellen werden gedetecteerd, resulterend in significant lagere gemiddelde VCM-waarden. De invloed van de Leja-12-telkamer op motiliteit van zaadcellen is daarom onafhankelijk van de SCA®s onderzocht door semenmonsters (n = 16) manueel te beoordelen in zowel het standaard natte preparaat als de Leja-12-telkamer. De resultaten lieten een goede correlatie voor het percentage progressief motiele zaadcellen zien (r = 0,95) met een iets lager gemiddeld percentage progressief motiele zaadcellen (-4,0% 95%-BI: -7,5 - -0,5). Bij regressieanalyse was geen sprake van een significant verschil tussen de manuele analyse in de verschillende preparaten.
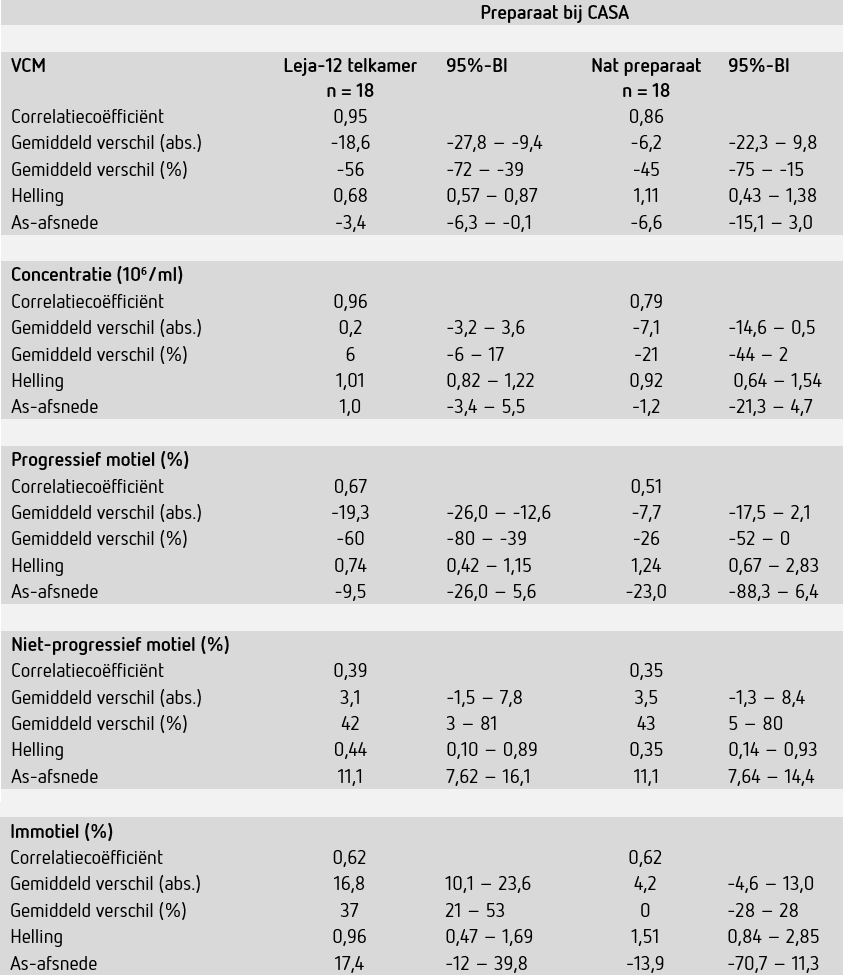
Correlaties voor de bepaling van concentratie en het percentage progressief motiele cellen waren minder goed voor CASAs in het natte preparaat. Hierbij moet opgemerkt worden dat tijdens CASAs regelmatig drifts in de natte preparaten werden geobserveerd. Daarom is aanvullend een “binnen-preparaat-tussen-videobeeld” herhaalbaarheidsanalyse uitgevoerd. De resultaten lieten voor het natte preparaat een significant grotere variatie (p = 0,0071) in concentratiemetingen (mediane VC: 23,4%; 95%-BI: 13,7 – 29,0) ten opzichte van metingen in de Leja-12-telkamers (mediane VC: 12,7%; 95%-BI: 7,7 – 16,7) zien. De variatie in motiliteitsbeoordeling was niet significant verschillend (p = 0,68) tussen het natte preparaat (mediane VC: 20,5; 95%-BI: 15,5 – 28,6) en de Leja-12-telkamer (mediane VC: 20,5; 95%-BI: 19,0 – 30,9). Op basis van bovenstaande resultaten is het vervolgonderzoek uitgevoerd in de Leja-12-telkamer.
Within en intermediate precisie
Het precisieonderzoek liet voor beide gebruikte SCA®s goede resultaten voor reproduceerbaarheid en intermediate precisie zien bij gebruik van de QCB-suspensies. De geobserveerde maximale VCs betroffen voor herhaalbaarheid en intermediate precisie respectievelijk 8,6% en 11,6%. Beide SCA®s voldeden daarmee aan de gestelde eisen.
Precisieonderzoek voor CASA in humane semenmonsters werd uitgevoerd om de herhaalbaarheid van de concentratiebepaling en motiliteitsanalyses in humaan semen vast te stellen. De herhaalbaarheid is weergegeven in precisieprofielen (figuur 1). Achteraf zijn voor één monster de resultaten van één van de vijf herhalingen geëxcludeerd. Bij dit monster was sprake van aanwezigheid van aggregaten in meerdere videobeelden, waardoor voor zowel de concentratiebepaling als beweeglijkheidsanalyse uitbijters ontstonden. Voor concentratiebepalingen betrof de gemiddelde binnen-preparaat VC 8,6% (95%-BI: 7,3 – 9,8) met een range van 3,2% tot 17,1%. De gemiddelde binnen-preparaat-VC voor het percentage progressief motiele zaadcellen was 12,4% (95%-BI: 10,1 – 14,7) met een range van 1,5% tot 21,7%.
Methodevergelijk in onbewerkte en bewerkte semenmonsters
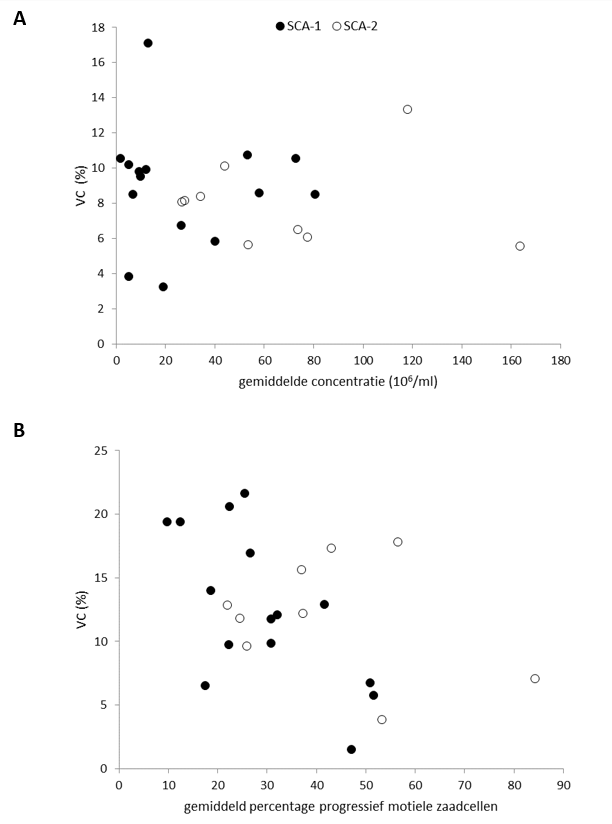
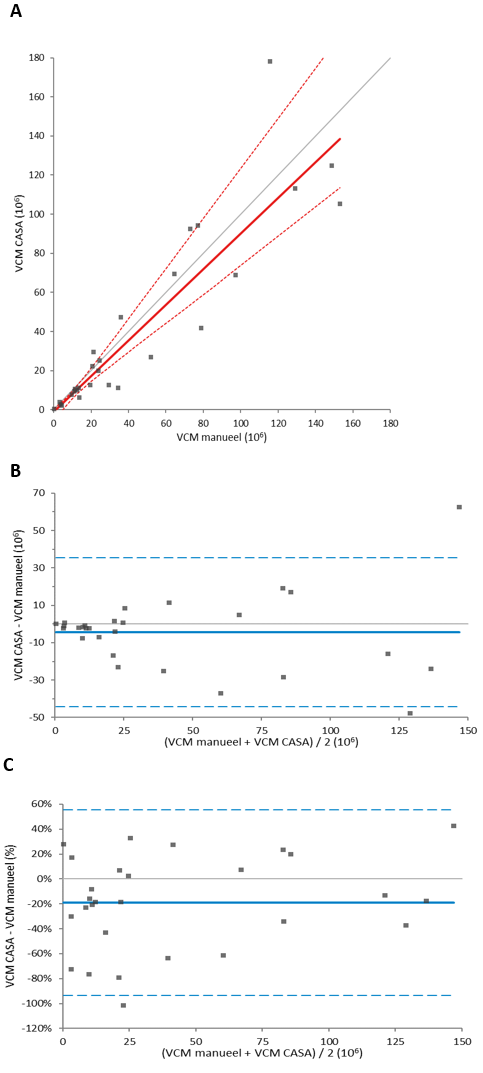
Het methodevergelijk in 64 onbewerkte semenmonsters (figuur 2A-C en tabel 5) liet voor VCM-waarden een redelijke correlatie (r = 0,78) zien met gemiddeld significant lagere waarden bij CASA (-19,1*106) ten opzichte van de manuele methode. De absolute verschillen waren met name groter bij hogere VCM-waarden, bij VCM <10*106 was de correlatie dan ook beter (r = 0,82). De concentratiebepalingen kwamen ook nu in de Leja-12-telkamer goed overeen (r = 0,95). Het verschil in VCM-waarden werd wederom veroorzaakt door een significant lager gemiddeld percentage progressief motiele zaadcellen (absoluut -16,8%, procentueel -48%) bij beoordeling door de SCA®. Bij het vergelijken van de motiliteitclassificaties bleek dat de SCA® een significant hoger percentage cellen classificeert als niet-progressief motiel en immotiel.
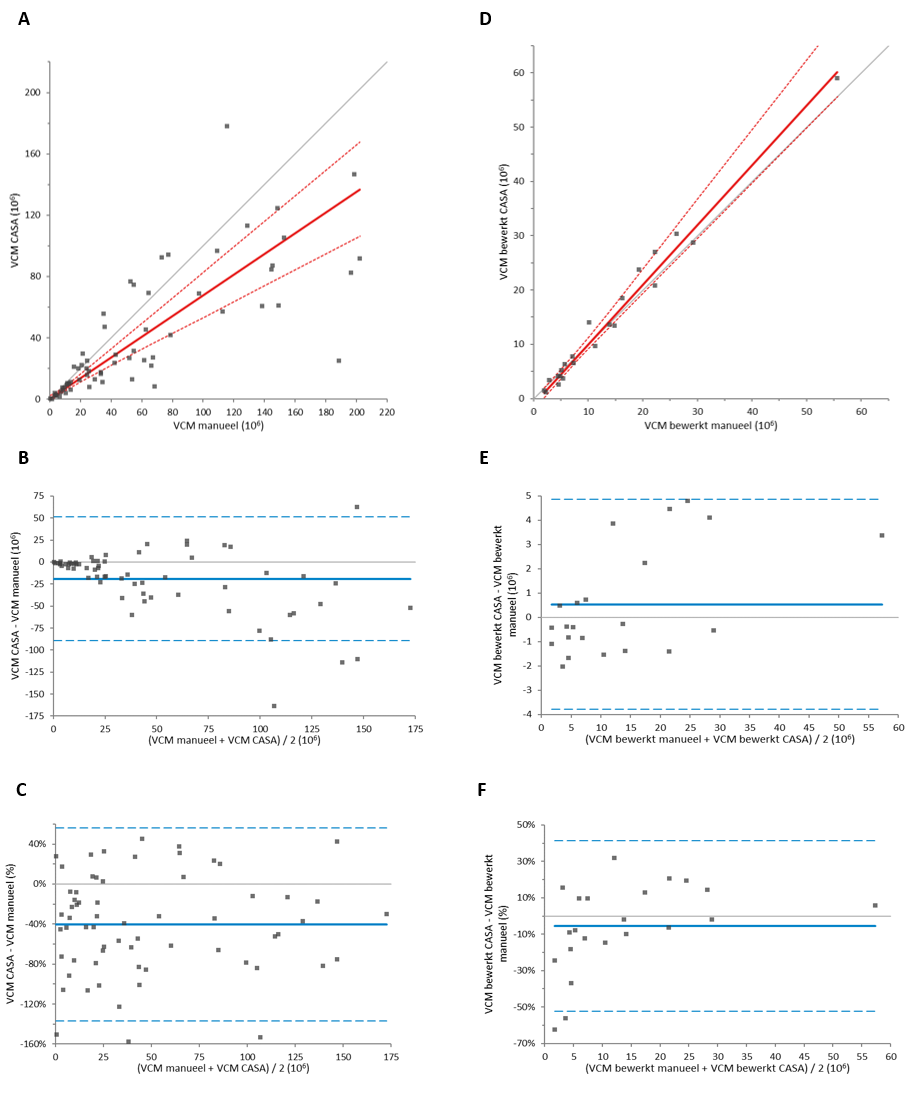
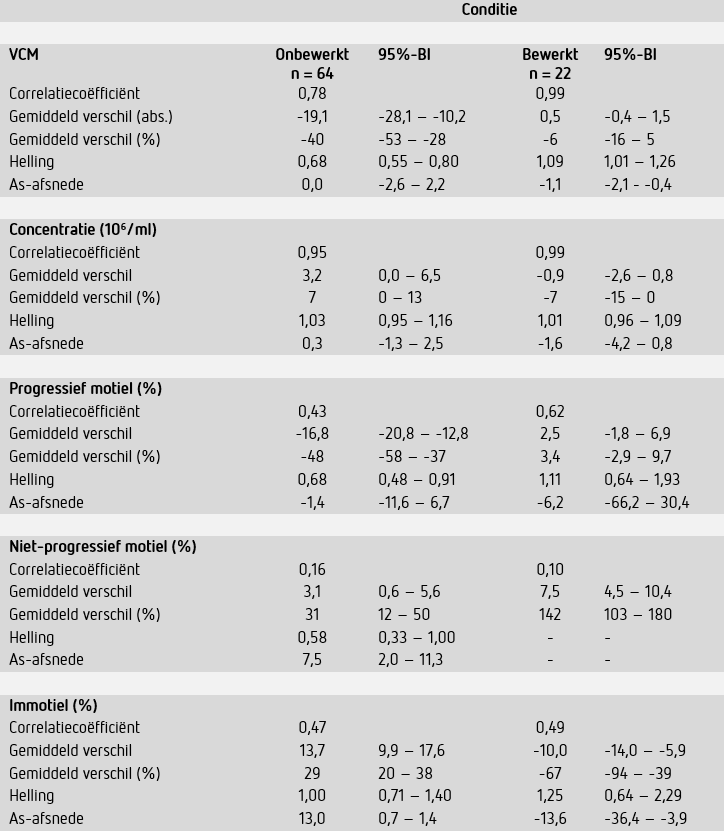
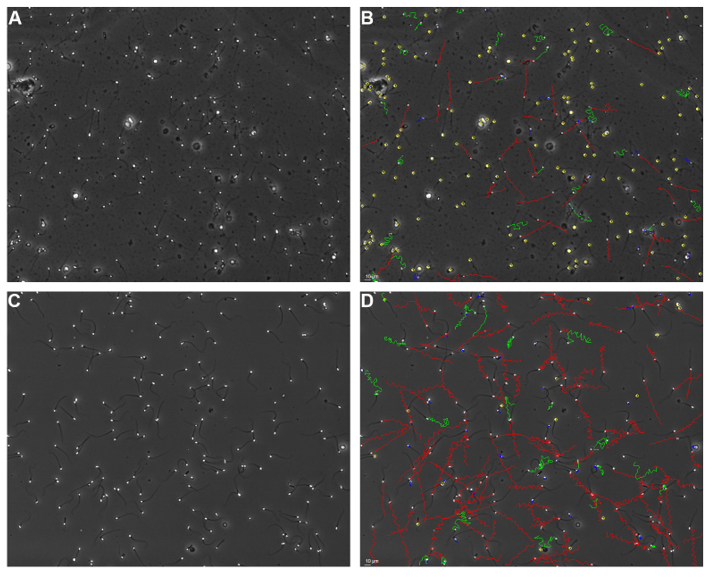
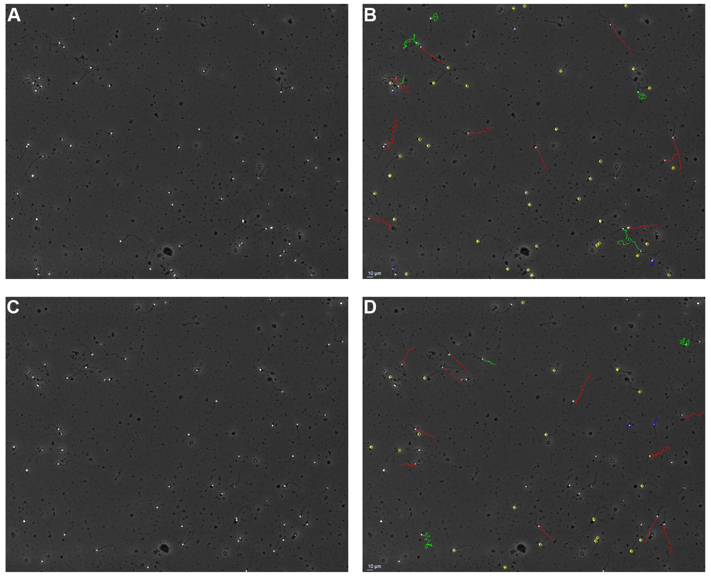
Met 22 bewerkte monsters zijn ook CASAs uitgevoerd (figuur 2D – F en tabel 5). In deze monsters kwamen resultaten voor VCM en de concentratie zeer goed overeen (beide: r = 0,99) en waren de gemiddelde verschillen van respectievelijk 0,5*106 (-6%) en -0,9*106/ml (-7%) veel kleiner dan in de onbewerkte monsters en statistisch niet significant (p = 0,87). De correlatie voor het percentage progressief motiele cellen (r = 0,62) bleek in vergelijking met onbewerkte monsters (r = 0,43) ook beter. Het gemiddelde verschil voor het percentage progressief motiele cellen tussen CASA en de manuele beoordeling betrof absoluut 2,5% (procentueel 3,4%) en was statistisch niet significant (p = 0,50). Figuur 3 geeft een impressie van de detectie en classificatie van zaadcellen in onbewerkte (A en B) en bewerkte (C en D) semenmonsters. De betreffende videobeelden zijn tevens online te bekijken.
SCA ® videobeoordeling door analisten
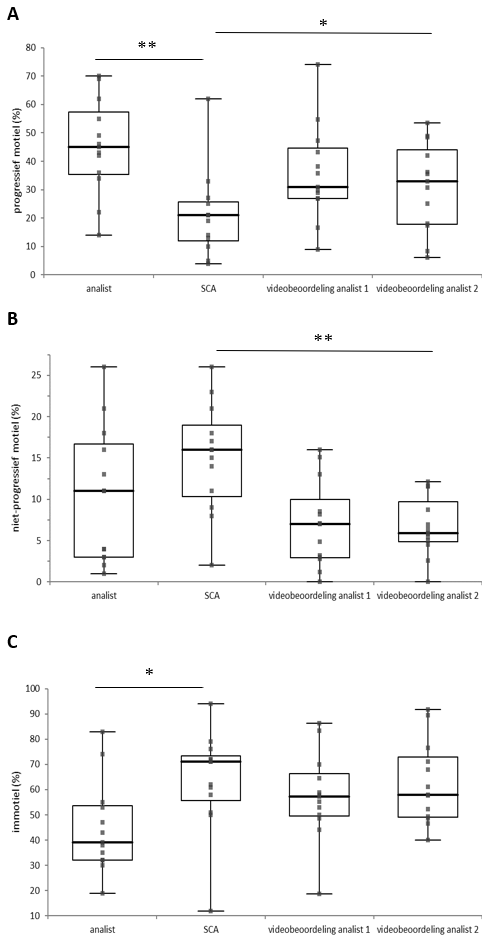
Op basis van de consistent lagere percentages progressief motiele zaadcellen bij CASA in onbewerkt semen vermoedden wij een significant detectie- en/of classificatieverschil voor niet progressieve en immotiele zaadcellen. In een aanvullend onderzoek zijn daarom de SCA® classificatie-instellingen voor motiliteit vergeleken met de criteria die getrainde analisten toepassen. Twee analisten hebben hiervoor een geblindeerde selectie van de eerder door hen opgeslagen SCA® videobeelden beoordeeld op motiliteit. Het betrof een selectie waarbij in het methodevergelijk grote (> 50%) verschillen werden gevonden voor het aantal progressief motiele zaadcellen. De videobeelden bevatten geen informatie over classificatie door de SCA®. In totaal werden 71 video’s behorend bij 13 patiëntenmonsters beoordeeld. De analisten werd gevraagd om alle zaadcellen in de videobeelden te classificeren voor motiliteit.
De SCA® detecteerde significant meer zaadcellen: mediane aantal 538 (95%-BI: 395 - 1180) dan de analisten met mediane aantallen: 230 (95%-BI: 156 – 282) en 330 (95%-BI: 238 – 500). Het percentage voor classificatie van progressief motiele cellen bleek door beide analisten bij de videobeoordeling minder te verschillen met de SCA® dan in vergelijking met de manuele analyse (figuur 4A). Wel was nog steeds sprake van een statistisch significant verschil tussen de videobeoordeling door analisten en de SCA® (p = 0,04). Beide analisten scoorden gemiddeld een lager percentage (-8%) niet-progressief beweeglijke cellen bij de videobeoordeling ten opzichte van de SCA® (figuur 4B). Het percentage immotiele cellen (figuur 4C) werd bij de videobeoordeling door beide analisten significant (p = 0,018) hoger gescoord ten opzichte van de eerdere manuele semenanalyse (mediaan 57% (95%-BI: 49 – 70) en 58% (95%-BI: 49 – 76) vs. 39% (95%-BI: 32 – 55)). Het percentage immotiele cellen was bij de videobeoordelingen door analisten statistisch niet significant verschillend (p = 0,36) met de classificatie door de SCA® (mediaan 71% (95%-BI: 51 – 76)).
Discussie
De hier beschreven verificatie van het Microptic SCA® Evolution systeem werd uitgevoerd in het kader van toepassing in het arbeidsintensieve proces van semenbewerking. Bij de manuele methode voor semenanalyse wordt gebruikt gemaakt van twee verschillende preparaten voor het enerzijds zo precies mogelijk vaststellen van de concentratie en anderzijds een goede beoordeling van motiliteit. Het is wenselijk om in hetzelfde preparaat zowel de concentratie als motiliteit te kunnen bepalen. Dit biedt het voordeel dat slechts één preparaat gemaakt moet worden, waardoor één configuratie van toepassing is en het risico op SCA® instellings- en meetfouten gereduceerd wordt.
Preparaatkeuze
Bij deze verificatie is eerst vastgesteld welk type preparaat het beste in combinatie met de SCA® gebruikt kan worden. De significante invloeden van preparaten en dieptes van telkamers op resultaten van manuele semenanalyses en CASAs zijn eerder al beschreven (8-11). Het gebruik van geschikte en voor het doel geverifieerde preparaten wordt dan ook aanbevolen in richtlijnen voor semenanalyse (5,6).
Het natte preparaat is volgens de SCA® leverancier niet geschikt voor concentratiemetingen vanwege de variabele diepte, maar kan wel voor motiliteitsanalyse gebruikt worden. De leverancier vermeldt in de handleiding verder dat de Leja-10- of Leja-12-telkamer geschikt is voor analyse van humaan semen met de SCA® (8). Op basis van praktische overwegingen is besloten om te starten met Leja-12 slides. Deze bevatten twee telkamers per slide, waardoor semenanalyses vóór en na bewerking van hetzelfde monster op dezelfde slide uitgevoerd kunnen worden. Onze resultaten bevestigden dat het natte preparaat niet gebruikt kan worden voor concentratiebepalingen met de SCA® en dat de Leja-12-telkamer een goed alternatief is voor CASA met de SCA®.
Precisie
Het precisieonderzoek met QCBs bleek goed uitvoerbaar. De beads worden door de SCA®s uitstekend gedetecteerd en zijn dus toepasbaar als controlemiddel op het goed functioneren van microscoop, camera en ingesteld preparaattype. Precisieonderzoek voor motiliteit is alleen mogelijk in verse semenmonsters en blijft daarmee beperkt tot het vaststellen van herhaalbaarheid binnen hetzelfde monster. Het acceptatiecriterium van maximaal 20% werd vastgesteld op basis van de variatie in resultaten van SKML-rondzendingen (periode 2015 t/m 2018) die al onze getrainde analisten beoordelen om bekwaam te blijven. Voor de concentratiebepaling door analisten werd een gemiddelde VC van 15% binnen een range van 7% tot 27% gevonden. Bij de beoordeling van progressief motiele cellen was de variatie onder analisten 13% binnen een range van 5% tot 32%. Wij verwachtten dat de SCA®s vanwege het gebruik van vaste instellingen en algoritmes beter zouden presteren met betrekking tot variatie. Hoewel in twee monsters voor de motiliteitsanalyse sprake was van een kleine overschrijding van het acceptatiecriterium, werd dit geaccepteerd in het licht van de VC-range die bij de analyse door analisten wordt gezien.
Juistheid
De WHO vermeldt de microscopische beoordeling als gouden standaard voor het vaststellen van concentratie en beweeglijkheid van zaadcellen (6,7). Desondanks blijft juistheid bij alternatieve methoden voor semenanalyse een lastig punt omdat referentiematerialen niet voorhanden zijn en ook de referentiemethode onderhevig is aan diverse bronnen van variatie. Bij het observeren van verschillen tussen resultaten van microscopische semenanalyse en CASA blijft het dan ook onzeker welke methode de waarheid het beste benaderd (4).
Verschillen in motiliteitbeoordeling tussen analist en de SCA®
Tijdens de verificatieperiode bleek een consistent beeld van hogere percentages immotiele zaadcellen bij CASA. Dit fenomeen verdween logischerwijs in bewerkte semenmonsters, waardoor sprake was van een hele goede correlatie tussen de uitkomsten voor semenparameters. Op basis hiervan is gebruik van de SCA® in ons laboratorium geschikt bevonden voor CASA van bewerkt semen.
Door manuele videobeoordelingen werd onderzocht in hoeverre classificatiecriteria van de SCA® en analisten het verschil in motiliteitbeoordeling beïnvloedden. De verschillen tussen manuele analyse en CASA bleken kleiner, wat suggereert dat analisten bij de manuele analyse immotiele zaadcellen missen en/of preferentieel (progressief) motiele cellen tellen. Echter was er nog steeds sprake van een significant lager percentage progressief motiele cellen bij analyse door de SCA®. Bij nakijken van videobeelden met de door de SCA® aangegeven classificaties viel op dat bij grotere discrepanties in celtellingen en motiliteitsbeoordeling sprake was van veel gedetecteerde immotiele “staartloze” elementen.
Overschatting van concentratie en percentages immotiele zaadcellen door detectie van debris deeltjes in onbewerkt humaan semen is een bekend fenomeen bij CASA-systemen (1,2,4). Het intelligent-filter van de SCA® is een middel dat kan worden ingezet om ongewenste overdetectie te reduceren (figuur 5). Tijdens de familiarisatiefase hebben wij CASAs uitgevoerd met standaard toepassing van het intelligent-filter. Omdat de resultaten in deze fase een consistente onderschatting voor de concentratie liet zien, is besloten het filter alleen bij significant opvallende hoeveelheden debris in te schakelen. Het wel of niet gebruiken van het filter werd overgelaten aan de inschatting van de analist.
Gebruik van intelligent-filter en ervaring analist
In 6 van de 64 CASAs voor het methodevergelijk in onbewerkt semen is het intelligent-filter toegepast. Bij nadere analyse van de gegevens bleek steeds dezelfde analist het filter gebruikt te hebben. Dit betrof ook de analist die tijdens het methodevergelijk de meeste CASAs (n = 28) heeft uitgevoerd en in de gehele verificatieperiode het meest ervaren is geraakt. Indien alleen de door deze ervaren analist uitgevoerde analyses worden vergeleken blijken correlaties voor concentratie (r = 0,97), percentage progressief motiel (r = 0,67) en VCM (r = 0,90) in onbewerkt semen veel beter (figuur 6). Over het volledige VCM-bereik was het gemiddelde verschil in VCM niet significant anders. Voor het klinisch relevante gebied (VCM <10) waren er te weinig datapunten (n = 10) om met voldoende zekerheid te stellen dat CASA door een goed getrainde analist geen significant ander klinisch beleid tot gevolg zou hebben.
SCA®-configuraties en QC-procedure voor detectie van wijziging van instellingen
De resultaten binnen dit verificatieonderzoek zijn, afgezien van de toepassing van het intelligent-filter, verkregen door beeldanalyses met dezelfde configuratie voor preparaattype, detectie- en restrictieparameters en instellingen voor motiliteitsclassificaties. Deze instellingen hebben grote invloed op de uitkomsten en zijn daarom vooraf vastgelegd en periodiek gecontroleerd. De SCA® heeft de mogelijkheid om met behulp van een QC-video de configuratie-instellingen te controleren.
Relevant om te vermelden is dat tijdens de verificatie de QC-video nog niet werd toegepast. Bij een aantal analyses is in de startfase van de verificatie per abuis gewerkt met verkeerde instellingen. Naderhand zijn de semenparameters voor deze analyses met de correcte instellingen herberekend en heeft dit voor uitkomsten van de verificatie geen gevolgen gehad. De incidenten illustreren echter wel dat een adequate QC-procedure voor het werken met correcte beeldanalyse-instellingen noodzakelijk is.
Conclusie
Wij hebben geconcludeerd dat de SCA® voor ons laboratorium een geschikt middel is voor het uitvoeren van semenanalyses in bewerkt semen. Wanneer analisten dusdanig ervaren zijn geraakt, zal een nieuw methodevergelijk moeten uitwijzen of ook onbewerkt semen met de SCA® beoordeeld kan worden.
Abstract
The Sperm Class Analysis (SCA)® Evolution system (Microptic S.L.) was evaluated for possible use during labour-intensive semen preparation procedures in our laboratory. The use of the Leja-12 counting chamber was firstly verified as an appropriate chamber for both concentration and motility measurements. Precision was evaluated by measurements of multiple levels bead suspensions. In addition precision profiles for both concentration and motility were established by measurements in fresh human sperm. Precision outcomes in bead suspensions were acceptable (within 8,6% VC, intermediate 11,6% VC) as were the precision profiles in comparison to technician EQAS results.
In gradiënt prepared semen the results for total amounts of progressively motile spermatozoa and concentration were very comparable with the manual microscopic semen evaluation. Results in non-gradiënt prepared semen were less comparable and showed consistently lower amounts of progressively motile spermatozoa. This was mainly due to overdetection of immotile non-spermatozoa, which was not corrected by inexperienced technicians or by using the SCA® intelligent filter. We conclude that with QC-procedures ensuring correct configuration settings the SCA® is suitable for the analysis of gradient prepared semen. Furthermore, proper evaluation by well trained and experienced technicians is an additional prerequisite for using the SCA® in non-prepared semen samples.