Samenvatting
In dit tweede deel van de serie complexe transfusiediagnostiek presenteren wij een stroomschema dat problematiek bij ABD-bloedgroepbepalingen behandelt, waarbij er een discrepantie is tussen de geobserveerde A- en B-bloedgroepantigenen op de patiënterytrocyten en de anti-A- en anti-B-antistoffen in het serum van de patiënt. Het schema stelt mogelijke oorzaken en vervolgonderzoeken voor, afhankelijk van de geobserveerde discrepantie. De transfusie-achterwacht kan dit stroomschema gebruiken wanneer hij/zij voor een dergelijke uitdaging gesteld wordt.
Inleiding
Bij een erytrocytentransfusie is toediening van een product met een compatibele ABO- en Rhesus D-bloedgroep van groot klinisch belang. Als een ABO-incompatibele transfusie gegeven wordt, kan een ernstige hemolytische transfusiereactie volgen door de aanwezigheid van natuurlijk voorkomende anti-A- en anti-Bantistoffen. Daarom is de correcte uitvoering en interpretatie van de ABD-bloedgroepbepaling een essentieel onderdeel van transfusiediagnostiek (1).
Bij het grootste deel van de patiënten zal de bloedgroepbepaling geen problemen opleveren. Het kan echter voorkomen dat er onduidelijkheid ontstaat over de precieze bloedgroep van de patiënt. In dit geval zal de laboratoriumspecialist klinische chemie/transfusie-achterwacht geraadpleegd worden om hier ondersteuning bij te bieden. Omdat er een scala aan mogelijke oorzaken is voor discrepante reacties bij de ABD-bloedgroepbepaling, kan een goed overzicht hiervan hulp bieden bij het oplossen van dergelijke problemen (2). In navolging op het vorige artikel in deze serie complexe transfusiediagnostiek (problematiek in het antistof identificatiepanel), presenteren wij hier een stroomschema dat problematiek bij de ABD-bloedgroepbepaling behandelt. Let wel, de lokale procedures betreffende erytrocytentransfusie kunnen per ziekenhuis verschillen. Deze publicaties dienen dan ook als handvatten bij ingewikkelde transfusievraagstukken.
ABD-discrepanties
Om de ABD-bloedgroep van een patiënt vast te stellen wordt deze op twee verschillende manier bepaald. Ten eerste worden de bloedgroepantigenen bekeken op de erytrocyten van de patiënt, door hier anti-A-, anti-B- of anti-D-antistoffen aan toe te voegen (de zogenaamde ‘voorkant’). Ten tweede wordt gekeken welke antistoffen in het serum van de patiënt aanwezig zijn, door hier testerytrocyten aan toe te voegen met A- of B-antigenen op het membraan (de zogenaamde ‘achterkant’ of serumcontrole). Deze tweede test dient als controle op de bloedgroepantigeenbepaling en zou een complementaire uitslag moeten geven. Het kan echter voorkomen dat de gevonden antigenen niet passen bij de gevonden antistoffen. De patiënt lijkt bijvoorbeeld het A-antigeen te hebben, maar het plasma reageert met A-testerytrocyten, en niet met B-testerytrocyten zoals verwacht bij bloedgroep A. Dit wordt een discrepantie genoemd. In dit artikel gaan we niet in op discrepanties t.o.v. eerder verkregen resultaten, waarbij uiteraard als eerste gedacht wordt aan een patiëntverwisseling.
In het stroomschema voor ABD-discrepanties maken we onderscheid tussen onverwacht positieve en onverwacht negatieve reacties, mixed field reacties (aanwezigheid van zowel een positieve als een negatieve populatie cellen) en positieve controles (Figuur 1 - downloaden) (3-5). Voor het vinden van een oorzaak is het daarbij belangrijk om in te schatten of de onverwachte reactie bij de bloedgroepantigeenbepaling of de serumcontrole hoort. Om hierachter te komen raden we aan om allereerst naar de reactiesterktes te kijken. In ABD-testen worden reactiesterktes van 3+/4+ verwacht. Zwakkere reacties kunnen impliceren dat er bij deze test iets abnormaals aan de hand is, en de kans is groot dat een zwakke reactie dus de afwijkende reactie is. Daarnaast geldt dat er vaker problemen zijn met de antistoffen dan met de antigenen van de patiënt, waardoor afwijkingen bij discrepanties vaker voorkomen in de serumcontrole.
Onverwacht positieve reacties
Bloedgroepantigeenbepaling
Onverwacht positieve reacties bij het testen van de AB-bloedgroepantigenen van de patiënt kunnen tijdelijk voorkomen bij recente erytrocytentransfusie (of allogene stamceltransplantatie of zwangerschap), als de donor een andere bloedgroep heeft dan de ontvanger. Deze situaties zullen typisch leiden tot mixed field reacties (zie ook verderop in het stroomschema). Eenzelfde beeld wordt gezien bij chimerisme, een zeldzame situatie waarbij er in de baarmoeder uitwisseling van bloedvormend weefsel plaats heeft gevonden tussen de twee embryo's van een tweeling, of een fusie heeft plaatsgevonden van twee prille embryo's tot één individu (6,7).
Daarnaast kan er sprake zijn van vals-positieve reacties bij de bloedgroepantigeenbepaling als de erytrocyten van de patiënt in vivo al geagglutineerd zijn. Een voorbeeld hiervan is geldrolvorming (pseudoagglutinatie). In deze situatie is er sprake van agglutinatie van de erytrocyten door een verlaagde albumine:globuline ratio bij hypergammaglobulinemie (bijvoorbeeld bij multipel myeloom of ziekte van Waldenström). Als dit de oorzaak is van de onverwacht positieve reactie(s), zouden de reacties moeten verdwijnen na het wassen van de patiënterytrocyten.
Bij onderzoek aan navelstrengbloed kan Whartonse gelei, een eiwitstructuur afkomstig uit de navelstreng, zorgen voor spontane samenklontering van erytrocyten, met vals-positieve reacties als gevolg (8). Ook in dit geval zou het wassen van de erytrocyten uit het navelstrengbloed tot een betrouwbare bloedgroepbepaling moeten leiden.
Verder kunnen koude (complete) autoantistoffen de oorzaak zijn van de agglutinatie van de erytrocyten van de patiënt. Als dit vermoed wordt, kan geprobeerd worden om de bloedgroep bij 37°C te bepalen, zodat de koude antistof (AS) niet stoort. Daarnaast kan een AS screeningspanel ingezet worden (zo nodig koud) om de typering van de AS te bepalen als verder onderzoek nodig is.
Een zeer zeldzame oorzaak van vals-positieve reacties is polyagglutinatie, waarbij de erytrocyten van de patiënt agglutineerbaar zijn met het serum van vrijwel alle andere volwassenen, en dus ook met de polyklonale reagentia die gebruikt worden in de test (9). In dit geval is de enige oplossing het gebruik van monoklonale reagentia, waarvoor een referentielaboratorium (bijvoorbeeld Sanquin) ingeschakeld kan worden.
Een fenomeen dat wordt gezien bij gebruikers van Bio-Rad is dat microcytaire patiënterytrocyten zich minder goed door de gel van de testkaartjes kunnen bewegen, waardoor een zweem onderin de kolom gezien wordt. Dit kan lijken op een positieve reactie, maar is een technisch artefact. Een manier om te testen of dit de oorzaak is van de zweem is de kaartjes nogmaals af te draaien. Bij microcytaire anemie zal de zweem verdwijnen, bij een ware positieve reactie zal er niets veranderen.
Serumcontrole
Een veelvoorkomende oorzaak van onverwacht positieve reacties in de serumcontrole is een koude AS. Dit kan een allo-AS (bv. anti-M of anti-P1) of een auto-AS zijn (bv. anti-I, anti-H), die reageert met antigenen op de testerytrocyten. De autoantistoffen kunnen typisch voorkomen na een virusinfectie. Omdat de complete antistoffen sterk reageren bij lagere temperaturen, kan de bloedgroepbepaling warm uitgevoerd worden om de storing te verminderen. Verder kan besloten worden om de AS te typeren als dit relevant is voor het vervolgonderzoek.
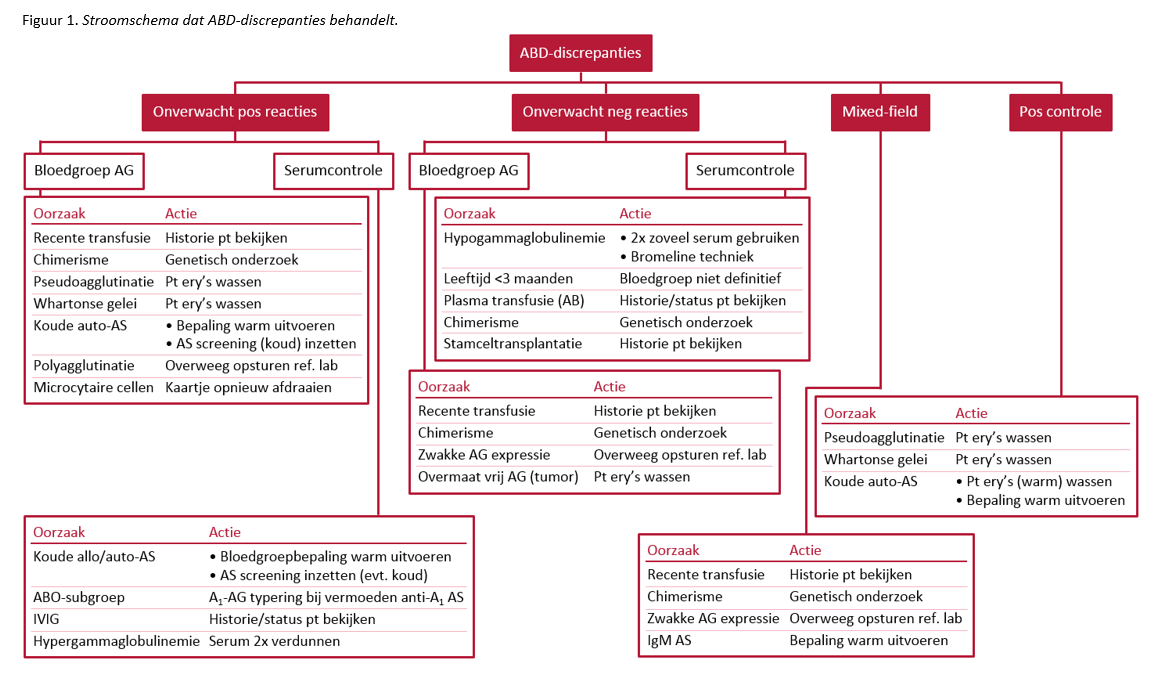
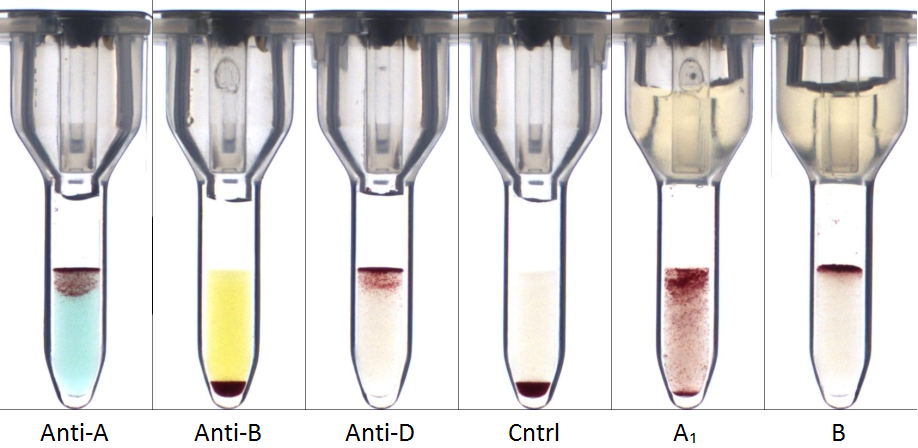
Een noemenswaardig voorbeeld van een allo-AS die stoort in de serumcontrole is anti-A1, een antistof die gevormd wordt door een significant deel van de patiënten met subgroepen A2 en A2B (10). In dit geval zal in de serumcontrole niet alleen een reactie met de B-testerytrocyten gevonden worden, maar ook met de A-testerytrocyten, omdat deze van het type A1 zijn (Figuur 2). Een eenvoudige test die een indicatie kan geven of er sprake kan zijn van een A2/A2B bloedgroep is een A1-antigeenbepaling van de patiënterytrocyten. Zo nodig kan m.b.v. genotypering bevestigd worden dat er inderdaad sprake is van een A2/A2B bloedgroep of een andere ABO-subgroep.
Daarnaast kan de toediening van intraveneus immunoglobuline (IVIG) zorgen voor onverwachte positieve reacties bij de serumcontrole (11). Omdat IVIG gemaakt wordt van plasma gedoneerd door gezonde donoren, kan hier een significante hoeveelheid anti-A en anti-B in zitten. Hoewel dit grotendeels IgG-antistoffen zijn, kunnen deze mogelijk toch agglutinatie en positieve reacties veroorzaken vanwege de hoge antigeendichtheid van A- en B-antigenen.
Tot slot kan hypergammaglobulinemie niet alleen bij de bloedgroepantigeenbepaling, maar ook bij de serumcontrole storen. De hoge concentratie immuunglobulinen kan voor pseudoagglutinatie van de testerytrocyten zorgen, met vals-positieve reacties tot gevolg. Zo nodig kan het plasma tweemaal verdund worden om de reacties te verzwakken of kan overwogen worden uit te gaan van de antigeenbepaling om de bloedgroep vast te stellen.
Onverwacht negatieve reacties
Bloedgroepantigeenbepaling
Recente transfusie kan, zoals eerder genoemd, zorgen voor positieve reacties en mixed field reacties bij de bloedgroepantigeenbepaling, als een andere bloedgroep wordt toegediend dan die van de donor. In extreme gevallen, wanneer er zeer veel bloed van een andere bloedgroep getransfundeerd is, kunnen onverwacht negatieve reacties echter ook het gevolg zijn. Dit wordt duidelijk omdat er een discrepantie is met de serumcontrole, die nog wel de oorspronkelijke bloedgroep van de patiënt weerspiegelt. Chimerisme kan, afhankelijk van de verhouding waarin de twee erytrocytenpopulaties voorkomen, ook gepaard gaan met onverwacht negatieve reacties in de bloedgroepbepaling.
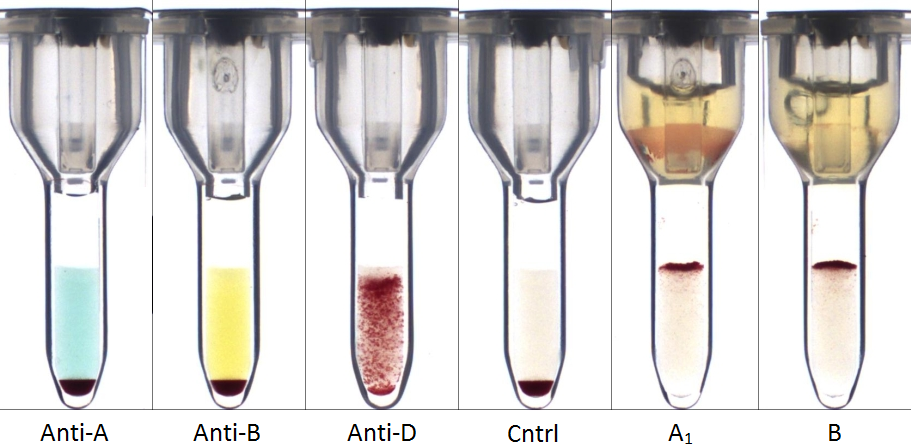
Een veelvoorkomende oorzaak van onverwacht negatieve reacties bij de bloedgroepantigeenbepaling is dat er minder antigeen aanwezig is op de erytrocyten dan normaal. In het geval van een zwakkere expressie van A- of B-antigenen kan dit komen doordat er sprake is van een ABO-subgroep (bv. A2B). Om dit aan te tonen is genotypering bij een referentielaboratorium nodig. In het geval van Rhesus D kan er sprake zijn van een D-variant, waarbij een deel van het D-antigeen mist, of een zwakke expressie van D, bijvoorbeeld door een genetische mutatie (Figuur 3) (12). Het maken van het verschil tussen een kwantitatieve of kwalitatieve afwijking kan relevant zijn, omdat in het tweede geval een antistof gevormd kan worden tegen het ontbrekende deel van het antigeen. Ook hierbij kan genetisch onderzoek helpen. Daarnaast kan een zwak antigeen ook van tijdelijke aard zijn. Dit komt bijvoorbeeld voor bij pasgeborenen, omdat zij nog geen volledige ontwikkeling van de AB-antigenen hebben, of bij myeloïde maligniteiten, waarbij afwijkingen in de stamcel zorgen voor verlies van het antigeen (13,14).
Tevens kunnen bepaalde maligniteiten (voornamelijk solide tumoren) onverwacht negatieve reacties veroorzaken met anti-A en/of anti-B sera, doordat de tumorcellen vrije bloedgroep antigenen kunnen uitscheiden. Deze zullen het antiserum tijdens de bloedgroepantigeenbepaling neutraliseren, waardoor er geen reactie meer plaatsvindt met de patiënterytrocyten (15). Om dit te voorkomen kunnen de patiënterytrocyten gewassen worden, om het vrije antigeen in het plasma te verwijderen.
Serumcontrole
Onverwacht negatieve reacties in de serumcontrole kunnen veroorzaakt worden door hypogammaglobulinemie, wat verschillende oorzaken kan hebben. Een verlaagde antistofproductie is fysiologisch bij kinderen jonger dan 1 jaar (16). In navelstrengbloed zal bijvoorbeeld in veel gevallen geen anti-A en/of anti-B aantoonbaar zijn. Dit is de reden dat de bloedgroep bij kinderen jonger dan 3 maanden niet definitief bepaald kan worden. In andere gevallen kan de productie van antistoffen onderdrukt zijn bij een immuundeficiëntie of door immunosuppressieve medicatie (17). In het geval van hypogammaglobulinemie kan het helpen om de test te herhalen met 2 keer zoveel serum, om de toegevoegde hoeveelheid antistoffen te verhogen. Alternatief kan het enzym bromeline gebruikt worden om de reacties van de AB-antistoffen met de testcellen te versterken. Als dit beide geen effect heeft kan overwogen worden uit te gaan van de bloedgroepantigeenbepaling om de bloedgroep vast te stellen.
Transfusie met grote hoeveelheden AB-plasma, zonder A- en B-antistoffen, kan ook leiden tot een vals-negatieve serumcontrole, omdat het eigen plasma met antistoffen verdund wordt.
Tot slot kunnen bij chimeren of na stamceltransplantatie antistoffen ontbreken tegen de bloedgroep van de 'getransplanteerde' cellen, waardoor de serumcontrole niet klopt met de bloedgroepantigeenbepaling (6,7).
Mixed field reacties
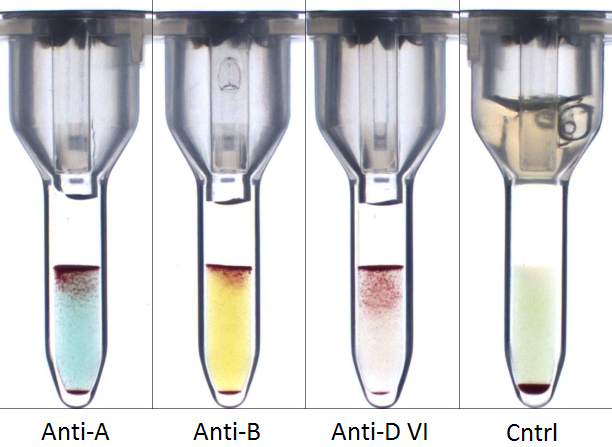
Mixed field reacties bij de bloedgroepbepaling kunnen zowel gezien worden bij de antigeenbepaling als de serumcontrole (18). In het geval van de antigeenbepaling is de meest voorkomende oorzaak dat er meer dan één populatie erytrocyten aanwezig is in het bloed van de patiënt (Figuur 4). Dit kan komen door een recente transfusie (of zwangerschap), stamceltransplantatie of chimerisme, zoals hierboven ook al genoemd. Bij een zwangere dient men bij een mixed field reactie altijd bedacht te zijn op foetomaternale transfusie. Daarnaast kunnen mixed field reacties voorkomen bij zwakke antigeenexpressie, bijvoorbeeld bij een zwakke Rhesus D. Als een mixed field reactie gezien wordt in de serumcontrole, is de meest voor de hand liggende oorzaak de aanwezigheid van een IgM-antistof, hoewel dit slechts zelden wordt gezien (18). De oorzaak voor dit fenomeen is onbekend.
Positieve controle
Bij de controle wordt gekeken naar het gedrag van de patiënterytrocyten, zonder toevoeging van een antiserum, om te beoordelen of de overige testen betrouwbaar geïnterpreteerd kunnen worden. Als de controle positief is, kan dit betekenen dat de cellen in vitro al geagglutineerd waren, bijvoorbeeld door pseudo-agglutinatie of koude autoantistoffen (zie ook boven). Daarnaast kan ook de aanwezigheid van Whartonse gelei bij navelstrengbloed een positieve controle veroorzaken. In alle gevallen kan het helpen om de patiënterytrocyten een aantal keren (warm) te wassen en de test te herhalen. Als opnieuw een positieve reactie wordt verkregen, mogen de resultaten van de bloedgroepbepaling niet geïnterpreteerd worden en moet gezocht worden naar een oorzaak van de positieve controle.
Conclusie
We hebben hier een stroomschema gepresenteerd dat kan ondersteunen bij ABD-discrepanties, waarbij de bloedgroepantigeenbepaling geen complementair resultaat geeft met de serumcontrole. We realiseren ons dat er vele uitzonderingen op de genoemde regels mogelijk zijn, waardoor een dergelijk schema nooit helemaal volledig kan zijn. We hopen echter dat dit stroomschema bij het grootste deel van de ABD-discrepanties kan helpen om een oorzaak te identificeren en de juiste vervolgstappen te nemen.
Disclaimer
Belangenconflict: geen. Financiële ondersteuning: geen.
Summary
In this second part of the series on complex transfusion diagnostics, we present a flowchart that deals with difficulties in ABD-blood group testing. Specifically, discrepancies between the observed A- and B-antigens on the patient erythrocytes and the anti-A and anti-B antibodies in the serum of the patient. The chart suggests possible causes and follow-up research, depending on the observed discrepancy. The blood transfusion specialist can use this flowchart whenever he/she is put to such a challenge.