Samenvatting
Metrologische traceerbaarheid is noodzakelijk voor vergelijkbaarheid van testresultaten tussen laboratoria. Het raakt de basis van de kwaliteit van bepalingen en is cruciaal voor harmonisatie naar referentiemethoden en standaarden. Richtlijnen hanteren vaak specifieke beslisgrenzen, waarbij aangenomen wordt dat testresultaten tussen laboratoria vergelijkbaar zijn. Het is aan de laboratoria om invulling te geven aan deze verwachting. Verschillende richtlijnen en normen zijn recent herzien – waaronder de IVDR en ISO 17511:2020 betreffende metrologische traceerbaarheid - waarbij met name striktere eisen worden gesteld aan producenten. Mede gezien de variabele implementatie van het traceerbaarheidsconcept is in 2017 een SKMS-project gestart om een knelpuntenanalyse uit te voeren, waarvan een invitational conference op 2 april 2019 onderdeel was. Belemmeringen die implementatie in de weg staan zijn beschreven evenals oplossingsrichtingen. De volledige knelpuntenanalyse is via de NVKC-website beschikbaar.
Inleiding
Uitwisselbaarheid van medische testuitslagen is een blijvend streven van klinische laboratoria. Daarbij is metrologische traceerbaarheid van centraal belang voor vergelijkbaarheid van testresultaten tussen methoden en tussen laboratoria. Het raakt de basis van de kwaliteit van bepalingen en is cruciaal voor harmonisatie naar referentiemethoden en standaarden.
Traceerbaarheid (of herleidbaarheid) wordt gedefinieerd als een eigenschap van een testresultaat of de waarde van een standaard, waarbij deze via een ononderbroken keten van kalibraties afgeleid kan worden van referentiemateriaal – meestal (inter)nationale standaarden – en waarbij elke stap een vastgestelde meetonzekerheid heeft (ISO 17511:2020)*. Het uiteindelijke doel van traceerbaarheid is dat verschillende meetmethoden van eenzelfde medische testparameter een equivalent resultaat opleveren.
Metrologische traceerbaarheid staat sterk in de belangstelling. Verschillende richtlijnen en normen die op traceerbaarheid betrekking hebben, zijn recent herzien of worden op korte termijn aangepast. Het correct documenteren van de metrologische traceerbaarheid is hierbij een striktere eis geworden voor producenten. Impliciet wordt daarmee aan professionele gebruikers nadrukkelijker de eis gesteld om op onvolkomenheden te reageren.
Het inzichtelijk maken van metrologische traceerbaarheid heeft tot doel verschillen tussen testuitslagen transparant en herkenbaar te maken. Zo worden onbedoelde verschillen tussen testuitslagen teruggedrongen en daarmee worden systematische verschillen en fouten in interpretatie die daarvan het gevolg kunnen zijn, voorkomen.
Richtlijnen en protocollen hebben eenheid gebracht in de medische behandeling van veel voorkomende aandoeningen. Richtlijnen hanteren vaak specifieke beslisgrenzen voor laboratoriumuitslagen, waarbij de ontwikkelaars van deze richtlijnen helaas te vaak aannemen dat testresultaten tussen laboratoria vergelijkbaar zijn. Medische richtlijnen bevatten zelden informatie over de bepalingsmethode van testen die van centraal belang zijn in het diagnostische beslissingsproces (1).
Voorbeelden van testen met een goed geregelde standaardisatie en traceerbaarheid zijn bijvoorbeeld HbA1c, cholesterol en kreatinine (2). Vooral op basis van externe kwaliteitscontrole blijken er echter significante verschillen te bestaan tussen methoden, zelfs als er referentiemethoden en/of -materialen beschikbaar zijn.
Wanneer er een systematische afwijking bestaat, blijken de effecten van ziekte-definiërende testen op populatieniveau steeds groot te zijn (3,4). Zo werden de gevolgen geëvalueerd van een systematische afwijking bij vijf verschillende bepalingsmethoden op het aantal patiënten gediagnostiseerd met hypercholesterolemie (5). De populatie met een naar schatting verhoogd risico nam met 48 procent toe bij methoden met een positieve afwijking, en nam met 54 procent af bij methoden met een negatieve afwijking. Een systematische afwijking in calcium kan aantoonbaar leiden tot extra kosten voor de behandeling per patiënt (6).
Gezien de variabele en trage implementatie van het metrologische traceerbaarheidsconcept is er in 2017 een project gestart met subsidie van de SKMS** om deze knelpuntenanalyse te maken. Onderdeel daarvan was een invitational conference die op 2 april 2019 is gehouden. De resultaten van de discussie zijn in de rapportage verwerkt. De voorliggende vraag was: welke belemmeringen zijn er die een optimale toepassing van deze principes en correcte implementatie van het concept van metrologische traceerbaarheid in de weg staan? Wanneer deze belemmeringen duidelijk zijn, zal dit naar verwachting richting geven aan praktische oplossingen. De volledige knelpuntenanalyse is via de NVKC-website beschikbaar.
Voetnoten
* 'property of the result of a measurement or the value of a standard whereby it can be related to stated references, usually national or international standards, through an unbroken chain of comparisons all having stated uncertainties'
** projectnummer 49596807
Regelgeving betreffende metrologische traceerbaarheid
Directieve In Vitro Diagnostic Devices
Belangrijke Europese regelgeving met betrekking tot metrologische traceerbaarheid van in vitro diagnostiek is de Directieve In Vitro Diagnostic Devices 98/79/EC (aangeduid als IVDD). Onder in-vitro diagnostica (IVDs) vallen volgens deze Europese regelgeving alle onderzoeksmiddelen (devices) zoals een reagens, kalibrator, controlemateriaal, meetinstrument of samengestelde meetsystemen bedoeld voor in vitro-bepalingen uit humaan materiaal.
Per 25 mei 2017 is nieuwe regelgeving voor IVDs in de EU aangenomen, met een overgangsperiode van precies vijf jaar. Deze EU-verordening (Regulation (EU) 2017/746) krijgt per 26 mei 2022 kracht van wet in de gehele EU (hier aangeduid als IVDR). Merk op dat een Directive een Europese regelgeving is die moet worden opgenomen in nationale wetgeving, terwijl een zogenaamde Regulation een verordening betreft die direct in de gehele EU kracht van wet heeft. Dit geeft ook het stringente karakter aan van de nieuwe regelgeving.
Metrologische traceerbaarheid komt op verschillende plaatsen in de IVDR aan de orde. De IVDR schrijft voor dat de prestatie-karakteristieken van een test worden beschreven, waaronder de metrologische traceerbaarheid van toegekende waarden (Art. 29.2). Tot de taken van de EU-referentielaboratoria behoort het verstrekken van aanbevelingen over geschikte referentiematerialen en referentiemeetprocedures van een hogere metrologische orde (Art 100.2).
Merk op dat de IVDD, IVDR en ISO 17511 de herleidbaarheid van kalibratoren en controlematerialen naar standaarden en methoden van een hogere orde voorschrijven, maar dat alleen door ISO 17511 de herleidbaarheid van testresultaten van patiëntenmonsters expliciet wordt geborgd, terwijl dat uiteraard wel de impliciete bedoeling van de opstellers van de IVDR was.
De beroepsgroep kan invloed uitoefenen op de wijze waarop de IVDR wordt ingevoerd. Er is op initiatief van de NVKC op nationaal niveau, samen met de andere laboratoriumdisciplines een taskforce ingesteld die zich richt op de interpretatie van de IVDR. Ook op het niveau van de EFLM zijn er initiatieven: twee EFLM-observers nemen deel aan de interpretatie van de IVDR in de werkgroepen ‘IVD’ en ‘emerging technology’ onder de Medical Device Coordination Group (MDCG) van de Europese Commissie; tevens wordt in 2020 een EFLM Task Group European Regulatory Affairs opgericht. Ten slotte draagt de EFLM-werkgroep ‘Test Evaluatie’ bij aan publieke consultatierondes waaraan elke leidraad (guidance document) op Europees niveau wordt onderworpen. De IVDR bepaalt zo de kaders; wat betreft de inhoudelijke aspecten, zoals eisen aan testkarakteristieken heeft alleen de beroepsgroep zelf de expertise die hiervoor bepalend is. Een punt van internationale aandacht betreft nog dat de Europese commissie bij een recente oproep voor de nominatie van normen waarnaar de IVDR harmonisatie behoeft, de recente ISO17511:2020 niet heeft geaccepteerd omdat vergeten is om van deze ISO (wereld) norm ook een EN (Europese) norm te maken. Momenteel wordt hard gewerkt deze omissie recht te zetten.
ISO 17511
De eisen omtrent metrologische traceerbaarheid in de IVDR zijn niet veel anders dan in de IVDD. De IVDR zal derhalve niet alle vraagstukken wat dit betreft oplossen; de nieuwe ISO 17511 zal daarentegen mogelijk meer invloed hebben. Wát er voor traceerbaarheid nodig is wordt geregeld via de IVDR; hóe dit geregeld kan worden is beschreven in de ISO 17511.
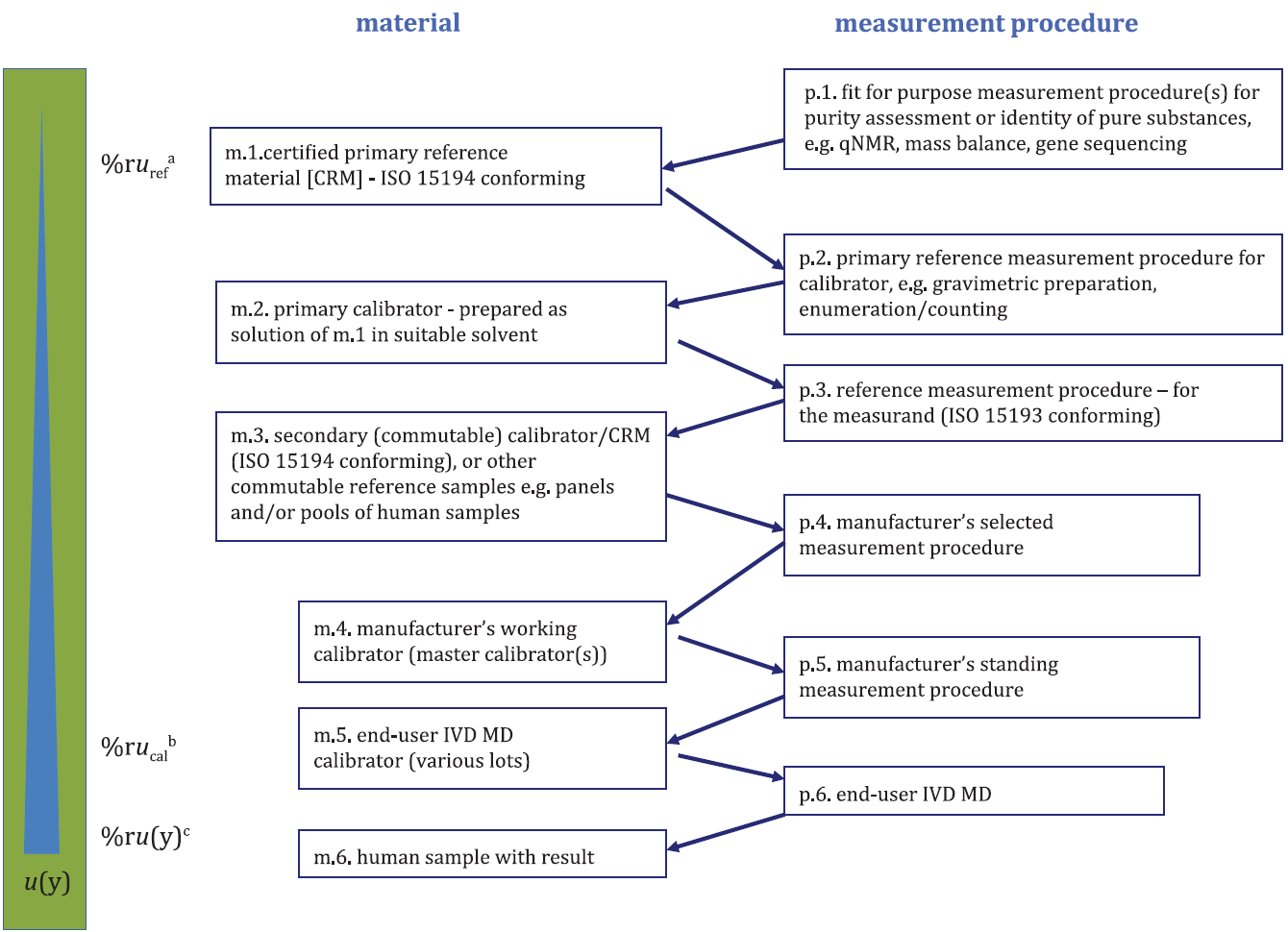
ISO 17511 is recent herzien en ook deze ISO-norm stelt meer eisen aan producenten. Het is echter nog de vraag hoe dit zich zal vertalen naar het werkveld, waar ontwikkelingen dreigen achter te blijven zonder druk vanuit de gebruikers. Net als de Europese regelgeving geldt voor de nieuwe ISO-norm een overgangsperiode, in dit geval van 3 jaar. In de ISO 17511 staat metrologische traceerbaarheid centraal, zowel van waarden van kalibratoren, van controlemateriaal als van meetresultaten in humane monsters. De herziene versie van ISO 17511 vereist dat een testresultaat in patiëntmateriaal herleidbaar moet zijn via een keten van bepalingsprocedures en kalibratoren/referentiematerialen van oplopende orde tot het hoogste beschikbare niveau van de te bepalen stof. In figuur 1 is de traceerbaarheid naar SI-eenheden schematisch weergegeven.
Waar de IVDD en IVDR zich beperken tot kalibratoren en controles, beschrijft de ISO-norm de gehele keten en heeft dus ook betrekking op bepalingsuitkomsten van patiëntmateriaal. De herziening van deze ISO-norm zal naar verwachting in grote mate bijdragen aan het juist documenteren van de metrologische traceerbaarheid door de producenten. De beschrijving van de traceerbaarheidsketen is nu vaak weinig transparant. Hierbij speelt een rol dat deze informatie door producenten als belangrijk concurrentie aspect wordt beschouwd. De nieuwe ISO 17511 zou voor uniformiteit moeten zorgen.
Bepalingen die door het laboratorium zelf ontwikkeld of aangepast zijn (Lab Developed Tests of LDTs) nemen een speciale positie in. Deze mogen alleen toegepast worden als er geen gelijkwaardig alternatief op de markt beschikbaar is voor de klinische toepassing. Hierbij staat het begrip “gelijkwaardig” nog ter discussie. Ook de door het laboratorium zelf ontwikkelde testen moeten straks aan de regelgeving van de IVDR voldoen en voorzien zijn van een onderbouwing van het ontbreken van een commercieel alternatief. Zolang de methode alleen op het eigen laboratorium wordt toegepast (en het laboratorium niet als producent wordt aangemerkt) zijn niet alle regels van toepassing. Algemene veiligheidsen prestatie eisen (zoals beschreven in bijlage 1 van de IVDR) gelden echter ook hier (7).
Joint Committee for Traceability in Laboratory Medicine
De Joint Committee for Traceability in Laboratory Medicine (JCTLM) is een internationale commissie die in 2002 werd ingesteld door het Bureau International des Poids et Mesures (BIPM), de IFCC en de International Laboratory Accreditation Cooperation (8). Het bracht drie hoofdzaken voor traceerbaarheid tot stand: referentiemethoden, referentiematerialen en een netwerk van referentielaboratoria. JCTLM onderhoudt een database voor deze drie onderdelen. Deze gegevens zijn algemeen toegankelijk via de website van het Internationale BIPM (2). Het doel van JCTLM is standaardisatie van laboratoriumresultaten bepaald met verschillende methoden, en zodoende juiste medische besluitvorming te verzekeren (9). Voor ontwikkelaars betekent opneming in het bestand van de JCTLM internationale erkenning van hun product.
Beschrijving van de traceerbaarheidsketen volgens ISO 17511
Een volledige traceerbaarheidsketen (figuur 1) is alleen mogelijk voor measurands die goed gedefinieerd zijn, waarvoor zowel een zuivere primaire standaard bestaat als een referentiemethode, en waarbij sprake is van commuteerbaarheid van het matrix-gebaseerde referentiemateriaal. Voor commuteerbaarheid wordt de volgende definitie gehanteerd (CLSI C53-P): de referentiemethode en de meetmethoden lager in de keten moeten voor referentiemateriaal en voor humaan materiaal equivalente resultaten geven*. Acceptatiegrenzen wat betreft vergelijkbaarheid van resultaten (limits for equivalence of reported values) moeten van tevoren worden vastgesteld (10). Wat precies onder vergelijkbaar wordt verstaan, is echter niet altijd eenduidig gedefinieerd, al worden in de EP-15 richtlijn hiervoor wel procedures beschreven.
Voetnoot
*letterlijk: ‘The equivalence of the mathematical relationships among the results of different measurement procedures for a reference material and for representative samples of the type intended to be measured.’
De ISO 17511-norm beschrijft een hiërarchie van zes verschillende situaties, waarbij in verschillende mate measurand, referentiemateriaal en referentiemethoden gedefinieerd en/of beschikbaar zijn (zie figuur 1):
- volledige herleidbaarheid naar referentiemateriaal, beschikbaarheid van een referentiemethode (bijv. glucose, cholesterol);
- beschikbaarheid van een referentiemethode, maar geen primaire kalibrator;
- beschikbaarheid van een referentiemethode, maar het measurand wordt bepaald door de referentiemethode zelf (niet door een onafhankelijke methode) (bijv. HbA1c);
- measurands waarvoor een gecertificeerd referentiemateriaal of een internationaal geaccepteerde kalibrator (met een consensus-gebaseerd protocol voor waarde toekenning) beschikbaar is, maar er is geen referentie meetmethode (bijv. WHO-standaarden zoals ferritine);
- en 6. measurands waarvoor noch een referentiemeetmethode, noch gecertificeerd referentiemateriaal of een internationaal geaccepteerde kalibrator beschikbaar is.
Knelpunten met betrekking tot metrologische traceerbaarheid
Harmonisatie van meetresultaten kan alleen door standaardisatie of ten minste harmonisatie van de metrologische traceerbaarheid
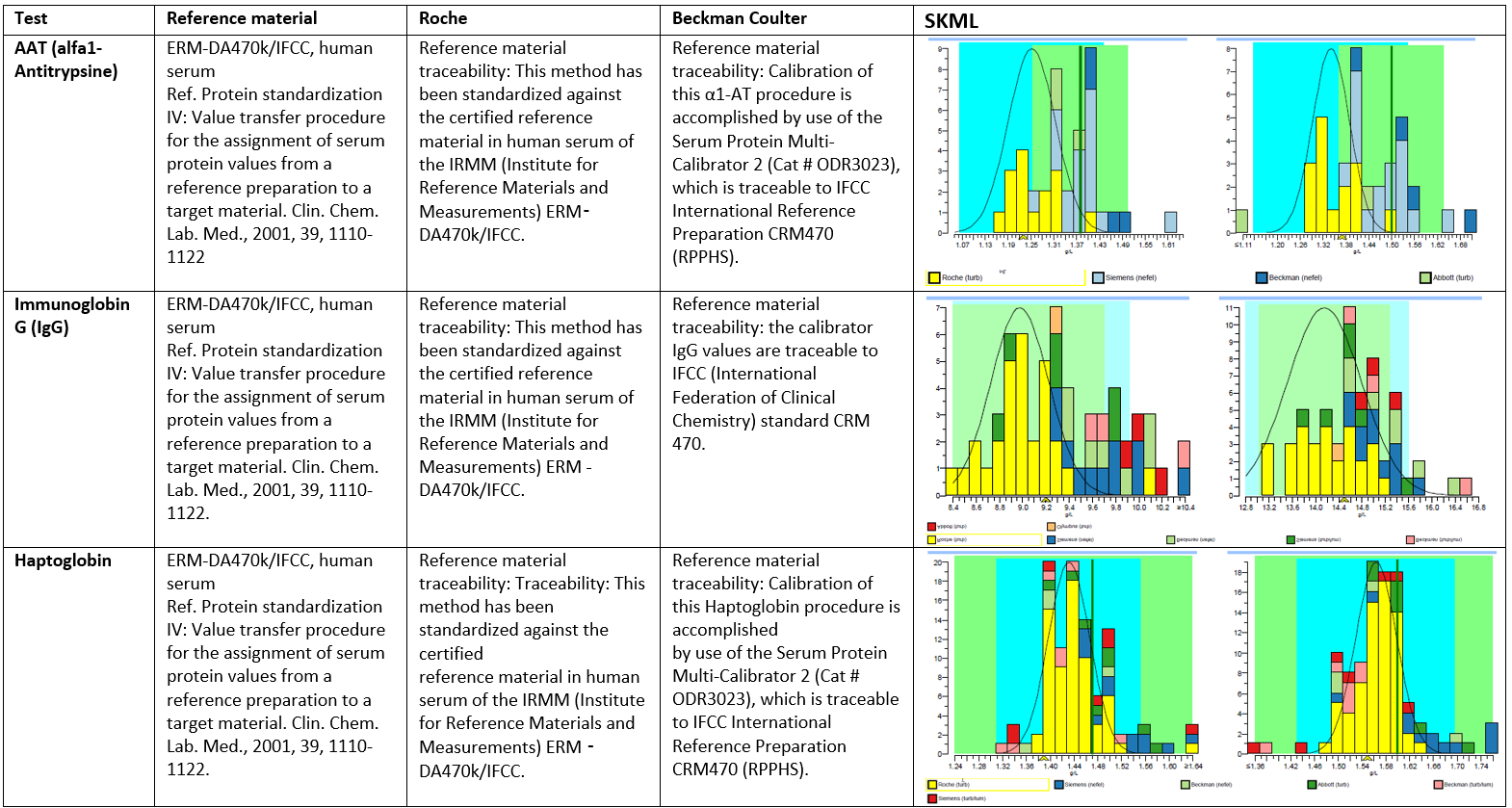
Zoals blijkt uit gegevens van externe kwaliteitscontrole (zie bijlage 1) leveren laboratoria niet altijd uniforme resultaten en zijn er significante verschillen tussen laboratoria die afhangen van de toegepaste bepalingsmethode (11). Het gebrek aan standaardisatie is terug te voeren naar verschillende oorzaken zoals beschikbaarheid of toepassing van standaarden, commuteerbaarheid van standaarden, gevoeligheid van meetmethoden voor matrixeffecten en keuze van meetmethoden door laboratoria. In bijlage 1 is te zien dat leveranciers voor dezelfde measurand een herleidbaarheid naar verschillende hogere methoden en/of standaarden documenteren. Zelfs zonder referentiemethode is hier harmonisatiewinst mogelijk door in ieder geval methoden naar dezelfde hogere methode en/of materiaal herleidbaar te maken.
Toch is ook identieke metrologische traceerbaarheid nog geen garantie voor de effectiviteit daarvan. Dat is te zien aan IgG in bijlage 1; daar bestaan ondanks op papier identieke metrologische herleidbaarheid naar eenzelfde referentiemateriaal toch grote tussen-methode verschillen.
Informatie rondom traceerbaarheid is vaak onvolledig voor de gebruiker
Hoe herkent de gebruiker een slechte traceerbaarheid? Zelfs wanneer traceerbaarheid naar een hogere standaard wordt opgegeven, is dit dan ook correct uitgevoerd door de producent? Wat betreft informatie van firma’s zou het laboratorium in principe toegang moeten hebben tot de volgende gegevens (9):
- een indicatie van de kalibratoren en meetmethoden van hogere orde die zijn gebruikt om waarden aan kalibratoren toe te kennen;
- welke interne kalibratie hiërarchie door de producent wordt toegepast;
- een gedetailleerde beschrijving van elke stap;
- de geëxpandeerde gecombineerde meetonzekerheid van de commerciële kalibratoren;
- welke grenzen worden gesteld aan te accepteren onzekerheid van de toegekende waarde van kalibratoren die werden gebruikt bij de validatie van het meetsysteem;
- informatie over lot-to-lot variatie en acceptatiegrenzen die hierbij gehanteerd worden.
In een beperkte steekproef bleek dat de informatie gegeven door de grotere producenten vaak onvolledig was (9) (zie ook bijlage 2). De EFLM-werkgroep ‘Accreditation and ISO/CEN standards’ heeft recent een aanbeveling opgesteld aan welke eisen de informatie met betrekking tot traceerbaarheid zou moeten voldoen (12). JCTLM heeft ook een aanbeveling opgesteld hoe traceerbaarheid gedocumenteerd zou moeten worden (zie: https://www.bipm.org/utils/en/pdf/JCTLM-EXEC-15-03.pdf).
Bij de zelfdeclaratie door IVD-producenten onder de huidige IVDD ontbreekt een controlesysteem van een onafhankelijke partij of de producent voldoet aan de gestelde eisen wat betreft traceerbaarheid (9). Borging door externe instanties (notified bodies) vindt straks wel plaats onder de IVDR.
Externe kwaliteitscontroles kunnen gebruikt worden als controle voor herleidbaarheid naar een hogere standaard
Alleen een klasse I extern kwaliteitsbewakingsprogramma dat gebruikmaakt van commuteerbare materialen met waardetoekenning in dezelfde hogere methode als de betreffende bepalingsmethode kan de adequate toepassing van metrologische traceerbaarheid voldoende borgen en worden toegepast als controle van de traceerbaarheid naar hogere standaarden. Daarnaast wordt deze kwaliteitscontrole toegepast om de juistheid van de bepalingsmethode te toetsen. Verschillende methoden behoren op een equivalent resultaat uit te komen, binnen de bandbreedte van de toelaatbare meetonzekerheid. Daarmee heeft de SKML als organisatie voor externe kwaliteitscontrole een belangrijke rol in het bewaken van de metrologische traceerbaarheid. Er zijn drie belangrijke eisen met betrekking tot deze externe controle:
- controlemateriaal moet homogeen, stabiel en commuteerbaar zijn;
- de waardetoekenning vindt plaats met een referentiemethode die door alle deelnemers geaccepteerd is, zodat de doelwaarde niet in twijfel wordt getrokken;
- interventie-ondersteunende rapportage: de deelnemers moeten kunnen zien of hun laboratorium anders presteert dan andere laboratoria, in termen van wel of niet klinisch acceptabel.
Op basis van de resultaten van externe kwaliteitscontroles kan worden nagegaan of de uitslagen – die herleidbaar zijn naar dezelfde standaard – ook daadwerkelijk vergelijkbaar zijn met elkaar of met een beschikbare referentiemethode. Indien er aanwijzingen zijn dat dit niet het geval is, en er sprake is van klinisch relevante afwijkingen, kan actie worden ondernomen.
Beschikbaarheid van standaarden en referentiemethoden van hogere orde is vereist
Het betekent een knelpunt als hogere standaarden of referentiemethoden niet beschikbaar zijn, zoals bij veel bepalingen het geval is. Referentiemethoden kunnen bovendien gevoelig zijn voor matrixeffecten. Niet alle gecertificeerde matrixgebaseerde standaarden zijn voor alle methoden commuteerbaar (10).
Hoe goed moeten de meetmethoden en de kwaliteit van kalibratoren zijn?
Een cruciale vraag bij kwaliteitscontrole is: hoe goed is goed genoeg? Wie stelt de tolerantiegebieden vast, en welke methode wordt hierbij gehanteerd? In 2014 is de Milaan-consensus opgesteld. Acceptatiegrenzen worden, afhankelijk van de testkarakteristieken en toepassing afgeleid van medische beslisgrenzen, biologische variatie of state of the art. Deze consensus beschrijft deze principes alleen in algemene termen. Wat betreft het afleiden van acceptatiegrenzen op basis van biologische variatie – de meest toegepaste methode – bestaat nu nog geen consensus (13). Deze grenzen zijn mede afhankelijk van de klinische toepassing van de test (denk aan huisartsen laboratorium versus transplantatie kliniek voor bijvoorbeeld een kreatinine-uitslag). Acceptatiegrenzen kunnen ook gebaseerd worden op klinische risico’s. Wat heeft de kliniek nodig en welk risico is nog acceptabel (bijvoorbeeld 1:100 of 1:10000 overlijden aan NSTEMI bij de bepaling van hs cardiale troponine)? Dit bepaalt de grens aan de kwaliteit van een test welke die nog acceptabel is.
Gegevens rondom meetonzekerheid zijn vaak onbekend
De producent van gecertificeerd secundair referentiemateriaal levert standaarden die commuteerbaar zijn en die een vastgestelde onzekerheid hebben. De IVDR en eindgebruikers verlangen dat producenten de meetonzekerheid van de kalibratieen controlewaarden opgeven. Deze gegevens zijn nu echter vaak onbekend. Daarbij wordt ook transparantie in batch-to-batch verschillen van kalibratoren verlangd. Door de afstemming tussen IVDR en ISO 17511 is het een duidelijke vereiste dat het uitdrukken van meetonzekerheid in maat en getal zich niet kan beperken tot kalibratoren en controles, maar ook betrekking heeft op het meetresultaat in patiëntmateriaal. Door ook de ISO TS 20914 over meetonzekerheid mee te nemen bij deze afstemming met de IVDR is duidelijk op welke wijze meetonzekerheid in maat en getal uitgedrukt dient te worden.
Producenten zijn verantwoordelijk voor een juiste traceerbaarheid naar een hogere standaard
Door Infusino et al. is de gebrekkige en moeizame implementatie van traceerbaarheid en standaardisatie van routine-enzymbepalingen beschreven (14). Dit geldt ondanks de voorschriften van de IVDD en de in de JCTLM-lijst opgenomen IFCC-bepalingsmethoden (RMPs of routine measurement procedures) voor enzymbepalingen (15). Vanwege kosten en beperkte middelen voeren IVD-producenten niet altijd een volledige, traceerbare kalibratie uit bij elke nieuwe batch van kalibratoren, maar wordt vertrouwd op intern (master) kalibratiemateriaal. In de meeste gevallen is deze procedure waarschijnlijk betrouwbaar, echter een veelgehoorde klacht is de variabiliteit tussen lotnummers van reagentia (batch-to-batch) (2).
IVD-producenten worden geconfronteerd met een woud aan weten regelgeving, naargelang het land of continent. Wijzigingen in de traceerbaarheidsketen na eerdere introductie van medische testen, roepen veel vragen op bij toezichthouders en brengen hoge kosten met zich mee om te voldoen aan de regelgeving van betreffende instanties. Het is de verantwoordelijkheid van de producent om te zorgen voor een juiste traceerbaarheid naar een (beschikbare) hogere standaard. Tevens is het de verantwoordelijkheid van de producent om de commuteerbaarheid van de standaarden te controleren en te waarborgen.
Traceerbare referentiewaarden en beslisgrenzen zullen zorgen voor complete standaardisatie van het testproces
Een complete standaardisatie van het testproces (analyse en postanalyse) kan pas bereikt worden als ook traceerbare referentiewaarden en beslisgrenzen beschikbaar zijn. Hiermee wordt de ruimte gedicht tussen het leveren van traceerbare resultaten en de correcte klinische toepassing ervan. In 2005 heeft de IFCC een commissie gestart, de Committee on Reference Intervals and Decision Limits (C-RIDL), met als doel traceerbare referentiewaarden (-intervallen) te beschrijven. Deze referentiewaarden hebben algemene geldigheid bij een correcte toepassing van de principes van traceerbaarheid (en bij vergelijkbare patiëntenpopulaties) (9).
Discussie
Metrologische traceerbaarheid is cruciaal om accurate en tussen laboratoria vergelijkbare resultaten te verkrijgen. Dit is noodzakelijk omdat patiënten op verschillende locaties behandeling kunnen vragen en krijgen. Volgens de perceptie van patiënten en clinici zijn uitslagen immers absoluut, dat wil zeggen een foutloos getal met universele geldigheid. Laboratoria streven ernaar om deze juistheid te bereiken, zij het met een onzekerheid die klinisch acceptabel is.
Organisatie rond referentiematerialen en -methoden
Voor een optimale standaardisatie zijn goede referentiemethoden nodig, evenals referentiematerialen, geaccrediteerde referentielaboratoria, maar ook wetenschappelijk onderbouwde referentie-intervallen en beslisgrenzen, een goede kwaliteitsbewaking, en ten slotte acceptatiegrenzen van de meetonzekerheid. De IVD-producenten hebben behoefte aan eenduidige acceptatiegrenzen, die realistisch en uitvoerbaar zijn. De eisen die worden gesteld aan de prestatie karakteristieken verschillen per klinische toepassing van de test. Deze eisen dienen in adequaat opgezette klinische studies uitgezocht te worden. Daarom is het vervullen van de clinical evidence eisen van de IVDR van groot belang: wetenschappelijk bewijs wat betreft de klinische validiteit van de test. EQA-organisaties zoals de SKML dienen in dat verband in de toekomst over te stappen van analytische prestatie specificaties op test niveau naar analytische prestatie specificaties op het niveau van toepassing van de test (16).
Verdeling verantwoordelijkheden
Producenten hebben een belangrijke taak om met hun medische testen te voldoen aan de eisen wat betreft metrologische traceerbaarheid, teneinde de klinische effectiviteit en veiligheid van medische testen niet nadelig te beïnvloeden. Bij wie ligt de taak om afwijkingen te signaleren en deze aanhangig te maken? Hoe liggen de verantwoordelijkheden wanneer een afwijking wordt geconstateerd en waar moet dit worden gemeld?
In het komende tijdperk van de IVDR kunnen notified bodies prospectief een belangrijke rol spelen in het borgen van metrologische traceerbaarheid van testresultaten. De nieuwe CE-markering die samenhangt met de IVDR schrijft standaardisatie van testen en traceerbaarheid van testresultaten voor. De SKML kan verschillen tussen methoden signaleren, onderzoeken of een verschil in metrologische traceerbaarheid het verschil kan verklaren, de commuteerbaarheid opnieuw toetsen en/of in dialoog gaan met de producent(en)*. Hierbij dient de informatie en onderbouwing van metrologische traceerbaarheid die producenten beschikbaar stellen aan de notified bodies ook toegankelijk te zijn voor de eindgebruiker.
Er kan ook een taak liggen voor de secties van de SKML. Voor een test kan standaardisatie door nieuwe ontwikkelingen mogelijk worden. Deze standaardisatie zal vervolgens door producenten geïmplementeerd moeten worden**. Vanuit de gebruikers kan daarmee op de toepassing van nieuwe standaarden en referentiemethoden worden aangedrongen. Bij de SKML-secties is deze expertise aanwezig. Zij kunnen benodigde informatie verzamelen op basis van gegevens van individuele laboratoria wat betreft afwijkingen, en kunnen dit bij de producenten onder de aandacht brengen. Producenten hebben zelf doorgaans geen rechtstreekse inzage in de resultaten van de externe kwaliteitscontrole, zodat alleen gebruikers deze informatie kunnen leveren. Toch biedt de SKML nadrukkelijk ook voor leveranciers de mogelijkheid om als deelnemer voor rondzendingen in te schrijven en rapportages te ontvangen die inzage geven over de prestatie van hun producten, ook als ze zelf geen analyse uitvoeren en/of resultaten daarvan insturen naar SKML.
Ten slotte nemen laboratoria zelf verantwoordelijkheid door – op basis van informatie die leveranciers behoren aan te leveren – zich op de hoogte te stellen van de benodigde gegevens over klinische bewijsvoering (clinical evidence) en prestatiekarakteristieken - inclusief metrologische traceerbaarheid - en klinische toepasbaarheid van testen en daar op gepaste wijze op te acteren.
Voetnoten
* Dit is bijvoorbeeld gebeurd met de bepaling van IgM.
** Bijvoorbeeld voor vrij T4
Nationaal of internationaal niveau
Metrologische traceerbaarheid heeft onmiskenbare internationale aspecten. Producenten werken internationaal, de huidige IVDD en de nieuwe IVDR zijn regelgevingen die in de gehele EU gelden en de ISO 17511 is een internationaal document.
Het Europese beleid houdt in, dat in deze internationale context lokale standaarden en normen vermeden moeten worden. Het interne marktprincipe eist een vrije circulatie van producten binnen de EU. Daarmee is het bereiken van harmonisatie van medische testresultaten middels metrologische traceerbaarheid een uitdaging die van lokaal naar nationaal en internationaal moet worden opgepakt. De IVDR heeft hierin voorzien door het instellen van een Medical Device Coordination Group (MDCG), waaronder > 10 werkgroepen ressorteren die de IVDR-wetgeving interpreteren en kaders uitwerken over het “wat”. Daarmee komen standaarden en afwijkingslimieten in een internationaal perspectief te staan. Dit roept zelfs de vraag op, of dit zich beperkt tot een Europees (EFLM) niveau, of zelfs geregeld moet worden op internationaal (IFCC) niveau.
Wat betreft afspraken over eisen met betrekking tot analytische prestatiekarakteristieken, zijn specificaties hiervoor afhankelijk van de toepassing(en) van een test. Dat vraagt om internationale consensus van laboratoriumprofessionals die het best georganiseerd kan worden door internationale wetenschappelijke organisaties zoals de EFLM en/of organisaties voor externe kwaliteitscontrole zoals de European Organization for External Quality Assurance Providers in Laboratory Medicine (EQALM). Deze organisaties zijn betrokken bij de uitvoering van de IVDR, en men is erop gericht lokale verschillen in toepassing van deze wet te voorkomen. Dit laat onverlet dat men op nationaal niveau invloed kan hebben. Het is nog onduidelijk of verschillen tussen landen (bijvoorbeeld wat betreft specifieke toepassingen, richtlijnen) zouden kunnen leiden tot verschillen op nationaal niveau met betrekking tot toepassing van de IVDR. Daarnaast heeft elk laboratorium uiteindelijk een eigen verantwoordelijkheid in het aanbieden van testen die geschikt zijn voor de lokale toepassingen.
Signaleren en melden van afwijkingen
Er is onder heldere randvoorwaarden (m.n. een mandatering) mogelijk een rol voor de SKML weggelegd bij het signaleren en melden van afwijkingen. Het bewijs van een afwijking is mede afhankelijk van bewezen commuteerbaarheid van de EQA-controlemonsters en de wijze waarop waarden zijn toegekend (zoals met internationaal erkende Referentie Meet Systemen). De SKML zal afwijkingen moeten kunnen duiden door juistheidsverificatie en benchmarking ten opzichte van de methodegroepen. De SKML heeft de rol om te signaleren en niet te oordelen.
Namens de gebruikers kan de SKML wel in gesprek gaan met producenten. Zo kunnen SKML-secties een taak krijgen in deze signaalfunctie en het bespreken van afwijkingen met producenten. Dat vereist wel een voorafgaand proces van standaardisatie tussen SKML-secties over de wijze waarop deze signaalfunctie wetenschappelijke verantwoord dient te worden uitgeoefend.
Onafhankelijk van het bovenstaande houdt ieder laboratorium eigen zeggenschap. Het blijft de verantwoordelijkheid van de laboratoriumprofessionals om, indien dat nodig wordt geacht, maatregelen te nemen dan wel af te wijken in het belang van de lokale omstandigheden.
Wat betreft het vaststellen van afwijkingen wordt het niet essentieel geacht dat externe kwaliteitscontrole internationaal wordt georganiseerd. De SKML moet echter aan enkele eisen voldoen: transparantie en aantoonbaar bewijs wat betreft de commuteerbaarheid van EQA-controlemateriaal en hoe de waardetoekenning is uitgevoerd (JCTLM geregistreerd controlemateriaal, erkende referentie laboratoria). Waar de SKML al wel transparant over is, maar collega EQA-organisatie nog niet, zijn de analytische prestatiespecificaties.
Soms worden er afwijkingen gezien, bijvoorbeeld bij de NEQAS, terwijl er bij de SKML-rondzending geen problemen zijn. Dit kan zowel aan verschil in EQA-materiaal, als bron van doelwaarde, als analytische prestatie specificaties liggen. Noch voor gebruikers, noch voor IVD-leveranciers zijn deze verschillen acceptabel en het komt het draagvlak niet ten goede als bij een afwijking bij één EQA, eenzelfde product bij een ander EQA met ruimere prestatie-eisen wel voldoet. Om mogelijk verschillende uitkomsten van een IVD-product in diverse nationale EQAs te verklaren dienen EQAs via Europese afstemming te komen tot transparantie en vergelijkbaarheid over hun methoden en prestatie eisen.
EQALM kan hier een rol spelen wat betreft regulatie en harmonisatie van externe kwaliteitscontrole programma’s. Het verdient aanbeveling dat de SKML afstemming zoekt op internationaal niveau via EQALM. Het ontsluiten van systematische afwijkingen op EU-niveau door het combineren van gegevens maakt het mogelijk om subtielere patronen en afwijkingen te signaleren.
Conclusies en oplossingsrichtingen
Keuze van meetmethode door gebruikers, rol van organisaties van gebruikers
Eindgebruikers moeten zich meer bewust worden van de principes van metrologische traceerbaarheid. Dit zou de keuze van een testmethode mede kunnen bepalen. Men zou bij voorkeur testen moeten implementeren waarbij traceerbaarheid naar de meest actuele standaarden van hogere orde goed is geregeld.
Door de gebruikers (-vereniging/-vertegenwoordiging) kan de juistheid van de traceerbaarheidsclaim gecontroleerd worden door de traceerbaarheidsketen zoals toegepast door de producent in detail na te gaan. In theorie moet de claim kloppen, als alle stappen vanaf de hoogste standaard correct zijn uitgevoerd. Welke gegevens precies nodig zijn om dit sluitend te kunnen controleren hangt af van de toegepaste standaarden en referentiemethode(n).
Het beschikbaar hebben van alle technische middelen is nog niet voldoende voor een correcte implementatie van traceerbaarheid. Er moet een sterke intentie zijn vanuit de professionele organisaties om te komen tot een succesvolle harmonisatie van testen. Weerstanden tegen invoering bij laboratoria en clinici kunnen gebaseerd zijn op conservatisme (17). Harmonisatie van bepalingen zoals van enzymen wordt door betrokkenen soms van ondergeschikt belang gezien en niet als een essentieel onderdeel van de testevaluatie. Hierbij wordt het belang voor de patiëntenzorg niet altijd gezien. De concepten van metrologische traceerbaarheid en commuteerbaarheid blijken nog steeds slecht bekend en zijn vaak onvoldoende opgenomen in het curriculum of leerboeken (18). Naar verwachting zullen ontwikkelingen bij de producenten achterblijven als er geen druk vanuit de professionals wordt uitgeoefend.
Aansluiting bij nieuwe regelgeving en uitvoerende instanties
De huidige IVDD is gebaseerd op een goodwill approach waarbij IVD-producenten het leeuwendeel van de testen CE-markeren door zelfcertificering. Hoewel er sancties mogelijk zijn wanneer producenten zich niet houden aan de regelgeving, worden sancties niet altijd opgelegd. Het is in andere sectoren voorgekomen dat producten ten onrechte met een CE-markering op de markt zijn gebracht, waarvoor een lager btw-tarief geldt. Wordt er straks voldoende op toegezien dat producten met CE-markering daadwerkelijk voldoen aan ISO 17511:2020 waarin de metrologische traceerbaarheid wordt voorgeschreven? (19)
De nieuwe IVDR en ISO 17511:2020 stellen hogere eisen aan producenten, en geven gebruikers meer handvatten om producenten te bewegen de conformiteit van IVDs strikt te implementeren. Hoe vindt het beroepenveld aansluiting bij deze regelgeving en bij voorgestelde organisatie van controle-instanties?
Omdat zelfcertificering voor veel testen niet meer mogelijk zal zijn vanaf 2022, zullen dossiers veel vaker worden beoordeeld door notified bodies. Dat gaat dan bijvoorbeeld over het beoordelen van de resultaten van het klinische onderzoek; is de relatie tussen testuitslag en ziektemaat inderdaad zoals wordt geclaimd. Of met de nieuwe eisen ook een kwaliteitsslag wordt gemaakt is afhankelijk van de deskundigheid en effectiviteit van de notified bodies. Indien deskundigheid tekortschiet bestaat het risico dat ten onrechte dossiers goedgekeurd worden en daarmee testen ten onrechte een CE-markering krijgen. De deskundigheidsbeoordeling van notified bodies vindt plaats door ministeries en inspecties (VWS samen met IGJ). Producenten en overheden laten zich veelal adviseren en opleiden door consulenten, die echter vaak geen laboratoriumspecialist zijn.
Zowel notified bodies als deze autoriteiten erkennen de beperkingen van hun deskundigheid op dit terrein en rekenen op ontsluiting van dit soort kennis via de wetenschappelijke verenigingen betrokken bij IVDs. Er worden mogelijkheden gezocht om laboratoriumspecialisten een rol te geven bij het beoordelen van deze deskundigheid.
Deze ontwikkelingen leiden hopelijk tot een werkwijze in lijn met de nieuwe regelgeving: laboratoria streven naar toepassing van optimale bepalingsmethoden, producenten bewerkstelligen productverbetering en externe kwaliteitsbewaking maakt het succes daarvan meetbaar.
Bijlagen
Bijlage 1a
Systematische verschillen tussen commercieel beschikbare bepalingsmethoden.
Ferritine
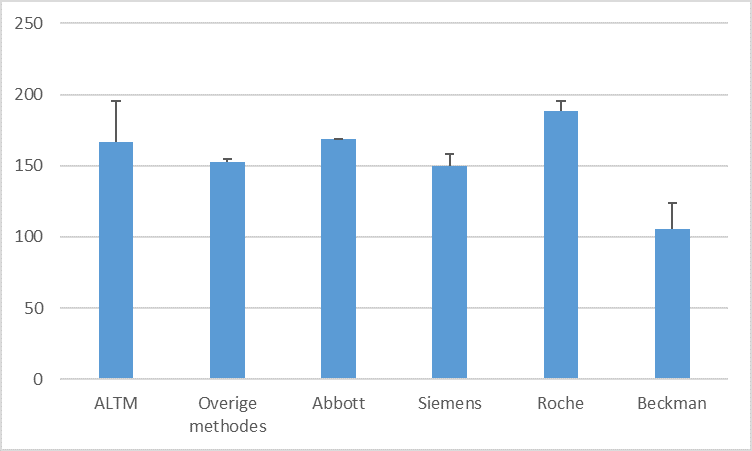
Voorbeeld van verschillen tussen testresultaten (SKML-rondzending 2020.1A) voor ferritine
(μg/L ±1 SD). Deze verschillen tussen methoden zijn slecht te verenigen met methode-onafhankelijke beslisgrenzen. Voor ferritine bestaat geen referentiemethode die door de JCTLM is geaccepteerd. Daarentegen bestaat wel een WHO-standaard voor ferritine (reagent 94/572). ALTM: All laboratory total mean.
Bijlage 1b
SKML-voorbeelden van tussenmethodeverschillen bij gelijke geclaimde metrologische traceerbaarheid. Evaluatie op 06-05-2020.
Bijlage 2
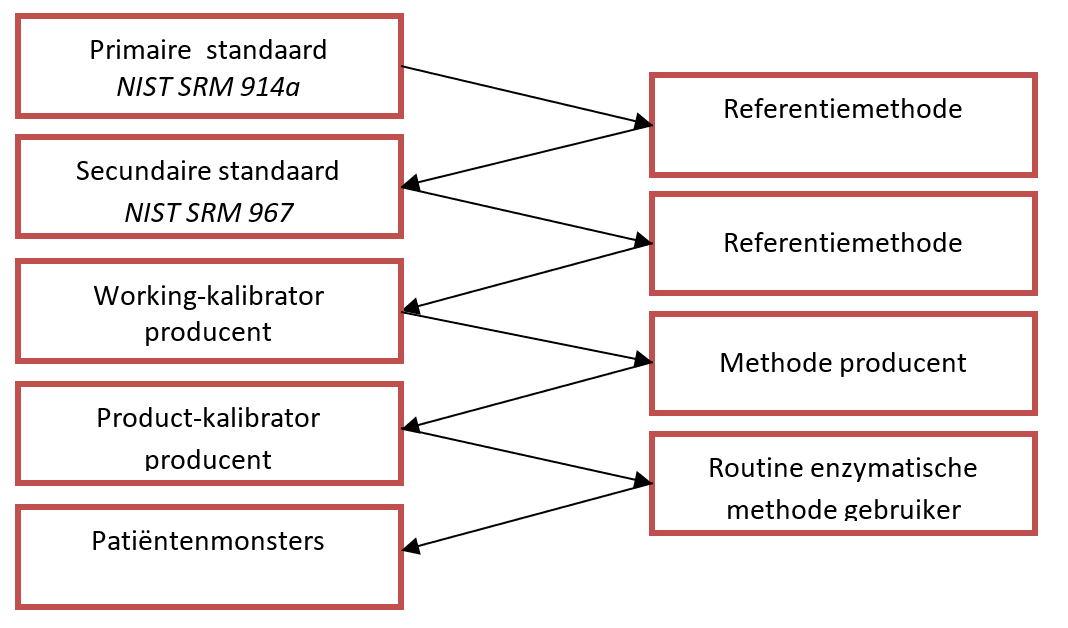
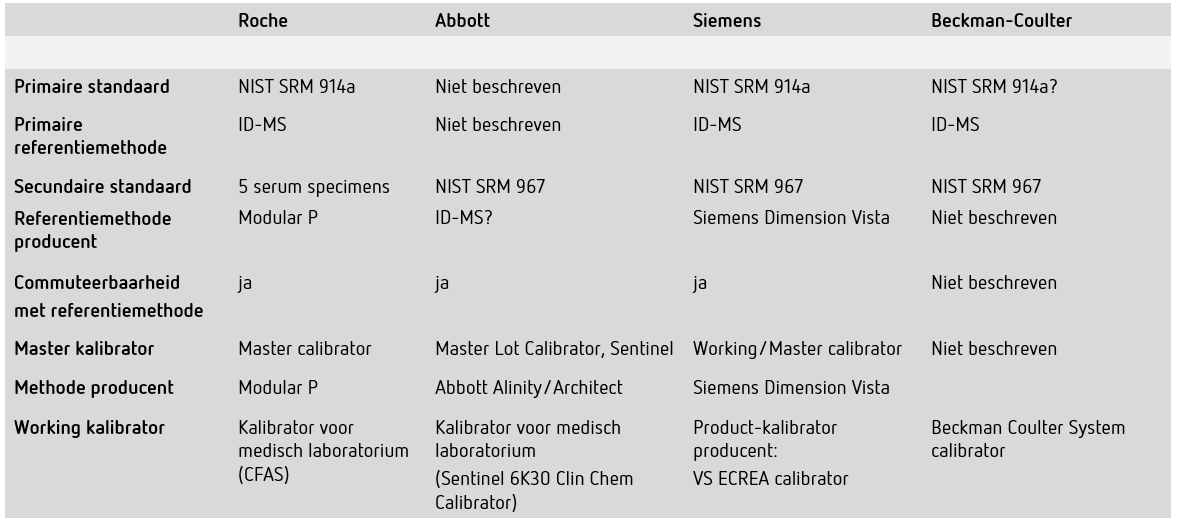
Voorbeelden van metrologische traceerbaarheid van de enzymatische kreatinine-bepaling van verschillende producenten. Onderstaande tabel geeft een schematische weergave van gegevens die zijn samengesteld uit beschikbare informatie zoals bijsluiters, en door navraag bij de producenten. Voor een volledige uitwerking van de metrologische traceerbaarheid per firma wordt verwezen naar de knelpuntenanalyse die te raadplegen is via de NVKC-website.
Summary
Metrological traceability is necessary for comparability of test results between laboratories. It touches on the basis of the quality of test results and is crucial for harmonization towards reference methods and standards. Guidelines often have specific decision limits, assuming that test results between laboratories are comparable. It is up to the laboratories to fulfill this expectation. Several guidelines and standards have recently been revised - including IVDR and ISO 17511:2020 on metrological traceability - with stricter requirements, in particular for manufacturers. Also in view of the variable implementation of the traceability concept, a SKMS project was started in 2017 to carry out an analysis of the limiting factors. This included an invitational conference on April 2, 2019. Barriers that hamper implementation are described as well as possible solutions. The full report is available on the NVKC website.