Samenvatting
In dit deel van de serie complexe transfusiediagnostiek worden speciële technieken besproken die regelmatig op transfusielaboratoria gebruikt worden. Dit wordt gedaan aan de hand van hun eigenschappen, de indicaties om ze in te zetten en aandachtspunten die belangrijk zijn om in het achterhoofd te houden bij het gebruik van deze technieken. Het kiezen van de juiste techniek in een bepaalde situatie is belangrijk om geld en kostbare tijd te besparen. Dit artikel kan de transfusie-achterwacht dan ook goed ondersteunen bij het maken van de juiste keuzes bij het inzetten van vervolgonderzoek na een positieve antistof screenings- en/of identificatiepanel.
Inleiding
Stel, u wordt als laboratoriumspecialist klinische chemie/transfusie-achterwacht benaderd door het transfusielaboratorium over een 34-jarige patiënte die opgenomen ligt op de afdeling Verloskunde. Zij heeft een positieve antistof (AS)-screening en er zijn enkele cellen in het AS-identificatiepanel positief. Er is echter geen specifiek patroon te ontdekken en alle klinische relevante antistoffen kunnen uitgesloten worden. Voor zover bekend is dit de eerste keer dat een positieve screening wordt gezien bij deze patiënt; zij is nog niet bekend met irregulaire antistoffen. U zult vermoedelijk als eerste kijken naar het dossier van deze patiënt, waarin u ziet dat zij op het punt staat te bevallen van haar tweede kind. Bij de vorige bevalling zijn twee erytrocytenconcentraten gegeven vanwege een fluxus postpartum. Onduidelijk is echter nog wanneer ze precies zal bevallen, of deze bevalling ingeleid zal worden, of er sprake is van een kritieke situatie en wanneer de eventuele transfusie precies nodig zal zijn. Wat gaat u doen? Welke extra technieken op uw transfusielaboratorium zijn er beschikbaar om verder onderzoek te doen? In welke gevallen zult u een referentielaboratorium, zoals Sanquin, in moeten schakelen voor vervolgonderzoek?
Deze serie artikelen over complexe transfusiediagnostiek heeft als doel te ondersteunen bij dergelijke situaties. In de eerdere artikelen zijn stroomschema's gepresenteerd die hulp bieden bij problematiek in het AS identificatiepanel en bij ABD-discrepanties. In het huidige artikel worden in aanvulling daarop verschillende technieken op het gebied van transfusiediagnostiek besproken, zodat in een specifieke situatie snel de juiste techniek gekozen kan worden voor vervolgonderzoek (1-4).
Technieken op het transfusielaboratorium
In dit artikel zullen technieken besproken worden die ingezet kunnen worden wanneer vervolgonderzoek nodig is na een positief AS-screenings- en/of identificatiepanel (Tabel 1 - downloaden). Hierbij wordt ervan uitgegaan dat in het transfusielaboratorium low ionic strength saline (LISS) als primaire techniek gebruikt wordt. Onderstaande technieken kunnen gebruikt worden om antistoffen te identificeren of uit te sluiten, of de aanwezigheid van bepaalde antigenen aan te tonen. Van elke techniek worden eigenschappen op een rij gezet, indicaties besproken om deze techniek in te zetten en aandachtspunten/valkuilen genoemd die belangrijk zijn om in het achterhoofd te houden wanneer de techniek gebruikt wordt. Een deel van deze technieken wordt normaliter gedaan in kant-en-klare kolommetjes met beads die na afdraaien een duidelijk verschil maken tussen vrije en geagglutineerde erytrocyten. Daarnaast kan gewerkt worden in glazen buisjes, waarbij agglutinatie visueel beoordeeld wordt in de suspensie van erytrocyten en plasma.
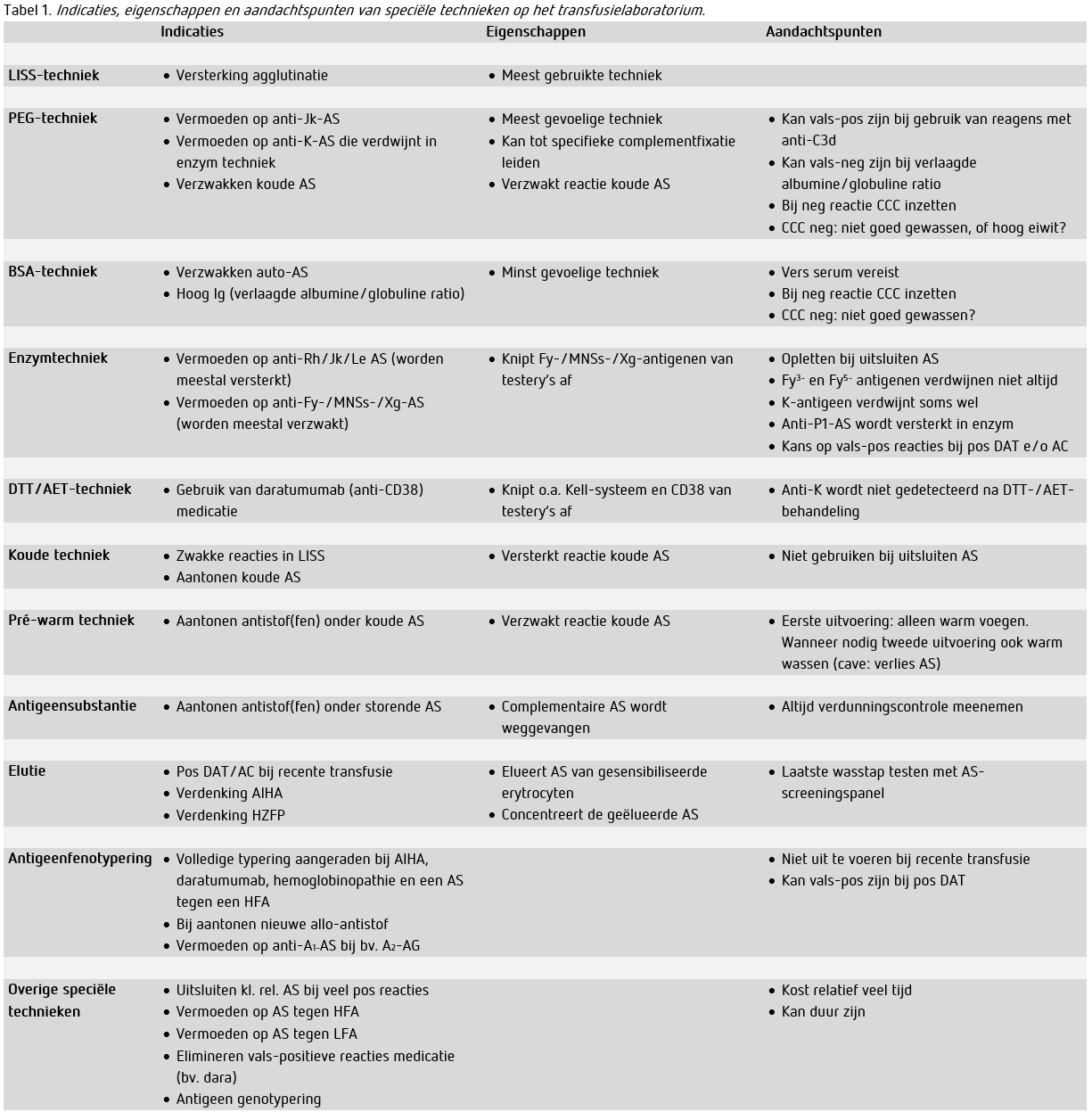
Agglutinatieversterkers
Agglutinatieversterkers intensiveren de interactie tussen de testerytrocyten en de antistoffen door bijvoorbeeld de afstoting tussen testerytrocyten te verminderen (5). Hierdoor kan een kortere incubatietijd aangehouden worden en heeft de indirecte antiglobulinetest (IAT) een betere sensitiviteit. LISS is een voorbeeld van een agglutinatieversterker die de zeta-potentiaal van de testerytrocyten verlaagt, waardoor er minder afstoting tussen de deeltjes plaatsvindt.
Polyethyleenglycol (PEG) is een wateroplosbaar polymeer dat water onttrekt aan het oppervlak van erytrocyten, waardoor deze gemakkelijker geagglutineerd kunnen worden. Bovendien neemt bij de wateronttrekking ook de antistofconcentratie in het plasma toe, wat agglutinatie bevordert. De PEG-techniek is de meest gevoelige techniek voor antistofdetectie, en is in het bijzonder geschikt voor de detectie van Kidd antistoffen (3). Koude antistoffen reageren over het algemeen zwakker in de PEG; de techniek kan dus gebruikt worden om interferentie door koude antistoffen te verminderen. Een nadeel van de PEG-techniek is dat er aspecifieke complementfixatie kan optreden. Men moet er dus op bedacht zijn om een antiglobuline reagens te gebruiken zonder anti-C3d, om vals-positieve reacties te voorkomen. Verder kunnen vals-negatieve reacties optreden wanneer de albumine/globuline ratio verlaagd is (bv. bij multipel myeloom of ziekte van Waldenström). Tot slot is het belangrijk om bij de PEG-techniek, en overige technieken die in buisjes gedaan worden, Coombs controle cellen (CCC) te gebruiken bij een negatieve reactie om te controleren dat de test correct uitgevoerd is. Een negatief resultaat in de IAT is alleen te vertrouwen als de CCC daarna geagglutineerd kunnen worden.
Bovine serum albumine (BSA) is een eiwit dat de zeta-potentiaal van testerytrocyten verlaagt, via een mechanisme dat nog niet tot in detail opgehelderd is. Het effect is in ieder geval dat er minder afstoting tussen de deeltjes is. De BSA-techniek is de minst gevoelige techniek, en kan daarom goed gebruikt worden om reacties als gevolg van autoantistoffen te verminderen. BSA is bij uitstek geschikt bij een verhoogd immuunglobuline en/of een verlaagde albumine/globuline ratio in het plasma, in tegenstelling tot bijvoorbeeld LISS en PEG. Een aandachtspunt is dat er in tegenstelling tot de andere genoemde technieken serum in plaats van plasma nodig is voor de test, waar wellicht een nieuwe bloedafname voor nodig is.
Enzymtechniek
Proteolytische enzymen, zoals papaïne, bromeline en ficine, verwijderen (delen van) eiwitten op het membraan van testerytrocyten. Hierdoor wordt niet alleen de negatieve lading op het membraan verminderd waardoor agglutinatie versterkt wordt, maar kunnen ook bepaalde antigenen verdwijnen of juist meer bloot komen te liggen. Over het algemeen zal de reactiviteit van antistoffen met de Duffy, MNSs en Xg antigenen verminderen/verdwijnen na enzymbehandeling, en de reactiviteit met Rhesus, Kidd, Lewis en P1 antigenen gelijk blijven of versterken. Het precieze effect is echter sterk afhankelijk van het type enzym dat gebruikt wordt, en kan per casus ook subtiel anders zijn (6).
Het is belangrijk om bij het gebruik van enzym-behandelde testerytrocyten voorzichtig te zijn met het uitsluiten van antistoffen. Zo kan het in zeldzame gevallen voorkomen dat het K-antigeen verdwijnt na enzymbehandeling. Daarentegen verdwijnen de Fy3- en Fy5-antigenen weer niet altijd. Een ander belangrijk aandachtspunt is dat er bij een positieve directe antiglobulinetest (DAT) en/of autocontrole (AC) vals-positieve reacties gezien kunnen worden, veroorzaakt door aspecifieke autoantistoffen. Bij een positieve DAT of AC is de enzymtechniek alleen nuttig wanneer deze veroorzaakt wordt door een specifieke autoantistof of een nieuwe allo-antistof bij recente transfusie.
DTT/AET techniek
Dithiothreitol (DTT) en 2-(2-aminoethyl)isothioureum dihydrobromide (AET) zijn reducerende reagentia die disulfide bindingen tussen cysteïnes in eiwitten kunnen verbreken. Op het transfusielaboratorium kunnen deze reagentia net als enzymen gebruikt worden om bepaalde antigenen, zoals het Kell-systeem, te verwijderen van het membraan van testerytrocyten. De techniek is in opkomst omdat ook het CD38-antigeen ermee verwijderd wordt. Hierdoor kan interferentie door daratumumab, een nieuw geneesmiddel tegen multipel myeloom, teniet gedaan worden omdat dit middel gericht is tegen het CD38-antigeen (7).
Koude techniek
Het variëren van de temperatuur waarbij de testerytrocyten en het plasma van de patiënt geïncubeerd worden kan nuttig zijn om bepaalde antistoffen te versterken of juist te verzwakken. Wanneer een koude AS vermoed wordt (bijvoorbeeld bij zwakke reacties in de LISS), kan het panel geïncubeerd worden bij een lagere temperatuur dan 37°C. Als in dit geval sterkere reacties gezien worden is het waarschijnlijk dat er een koude AS aanwezig is. Hoewel koude antistoffen in de meeste gevallen niet klinisch relevant zijn, kan de koude techniek gebruikt worden om een koude AS te identificeren en zo onbegrepen reacties in het warme panel te verklaren. De veelvoorkomende koude antistoffen anti-I, anti-HI, anti-I en anti-H zijn te identificeren met een specifieke combinatie van testcellen (soms een ‘koude rij’ genoemd). Een significant deel van de koude antistoffen is echter aspecifiek, en zal zich niet laten identificeren in de kou.
Pré-warm techniek
Wanneer een koude AS te veel stoort bij de 37°C-testen, en men de AS wil afzwakken om naar eventuele onderliggende antistoffen te kijken, kan de pré-warm techniek gebruikt worden. Hierbij worden de testcellen en het plasma van de patiënt apart van elkaar voorverwarmd voordat ze aan elkaar toegevoegd worden, waardoor koude antistoffen minder kans hebben om aan de erytrocyten te binden (warm voegen). Wanneer dit onvoldoende resultaat heeft kan na de incubatie ook nog gewassen worden met warme buffer (warm wassen). De valkuil bij deze laatste stap is ongewenst verlies van warme antistoffen, dus het is aan te raden warm wassen pas te gebruiken wanneer warm voegen alleen niet voldoende effect heeft.
Antigeen substantie
Als de aanwezigheid van meerdere antistoffen vermoed wordt, maar geen goede identificatie mogelijk is vanwege de grote hoeveelheid positieve reacties, kan het nuttig zijn om een AS weg te vangen en naar de onderliggende antistoffen te kijken. Dit kan gedaan worden middels een complementaire, oplosbare antigeen substantie (8). P1- en Lewis-antigeensubstanties zijn bijvoorbeeld commercieel verkrijgbaar. Met deze techniek wordt indirect ook de desbetreffende AS aangetoond als er na incubatie met de antigeensubstantie een ander reactiepatroon waargenomen wordt. Een aandachtspunt bij deze techniek is om altijd een controle mee te nemen zonder antigeen, om te controleren of de verdunning van het plasma invloed heeft op de reactiesterktes.
Elutie
Elutie is een techniek die goed ingezet kan worden wanneer sensibilisatie van patiëntenerytrocyten met autoantistoffen (bv. bij auto-immuun hemolytische anemie, AIHA), of sensibilisatie van recent toegediende donorerytrocyten met allo-antistoffen (transfusie <3 maanden geleden) vermoed wordt, of wanneer er sprake is van hemolytische ziekte van de pasgeborene (HZFP). Elutie is in deze situaties bijzonder nuttig wanneer er geen antistoffen worden gedetecteerd in het plasma van de patiënt. Middels elutie worden de antistoffen van de gesensibiliseerde erytrocyten van de patiënt verwijderd, waarna deze getypeerd kunnen worden. Een bijkomend voordeel is dat de antistoffen tijdens het proces geconcentreerd raken, waardoor ze mogelijk beter detecteerbaar zijn dan in het plasma van de patiënt. Om de antistoffen te elueren zijn verschillende methoden beschikbaar (bv. hitte, lage pH), die allen hun eigen voor- en nadelen hebben.
Antigeenfenotypering
Antigeenfenotypering van patiëntenerytrocyten wordt aangeraden wanneer er nu of in de toekomst noodzaak zou kunnen zijn tot antigeencompatibele transfusies. Dit kan het geval zijn wanneer onderliggende antistoffen niet uitgesloten kunnen worden (storende autoantistoffen, antistoffen tegen een hoogfrequent antigeen (HFA) en bepaalde medicatie zoals daratumumab), of om antistofvorming bij risicogroepen te voorkomen (bijvoorbeeld hemoglobinopathieën) (1). Daarnaast wordt fenotypering standaard toegepast bij de identificatie van een nieuwe allo-antistof, om te bevestigen dat de patiënt negatief is voor het bijbehorende antigeen. Een mogelijke valkuil bij fenotypering is een complexe interpretatie bij recente transfusie, vanwege de aanwezigheid van donorerytrocyten. Daarnaast kan de fenotypering vals-positief kan zijn bij een positieve DAT. Dit effect is sterk afhankelijk van de techniek die gebruikt wordt om de antigeen fenotypering te doen en kan per antigeen verschillen. In beide gevallen kan, wanneer er geen haast geboden is, genotypering een uitkomst zijn. Hiervoor kan een referentielaboratorium ingeschakeld worden.
Een handige manier om antigeen fenotypering te gebruiken is om het vermoeden op een bepaalde AS te versterken, dan wel te laten wegnemen. Als er bijvoorbeeld een lage verdenking is op een anti-Fya-AS, maar deze niet volledig uitgesloten kan worden, kan een positieve Fya-fenotypering de aanwezigheid van deze AS zeer onwaarschijnlijk maken bij een negatieve DAT en AC. Hoewel het geen direct bewijs is, kan het wel een nuttige tool zijn om een compatibel bloedproduct te selecteren. Een andere nuttige toepassing is de A1-fenotypering, die wanneer deze negatief is het vermoeden op een anti-A1-AS kan versterken wanneer het de uitslag van een ABD-typering op een anti-A1-AS wijst.
Overige speciële technieken
Er zijn situaties te benoemen waarin bovengenoemde technieken mogelijk niet afdoende zijn om de aanwezige antistof(fen) te identificeren en overige klinische relevante antistoffen uit te sluiten. Voorbeelden hiervan zijn: veel positieve reacties (bijvoorbeeld bij een AS tegen een HFA of een combinatie van antistoffen), het vermoeden op een AS tegen een laagfrequent antigeen (LFA), de noodzaak tot antigeengenotypering, of bij vals-positieve reacties veroorzaakt door bepaalde medicatie. In dergelijke gevallen zijn bijvoorbeeld de absorptie techniek, testerytrocyten met zeldzame antigeen fenotyperingen of zeer speciële technieken nodig om het onderzoek sluitend te krijgen. Afhankelijk van de grootte van uw transfusielaboratorium zult u in deze situaties lokaal mogelijkheden hebben voor verder onderzoek, of heeft u hiervoor een referentielaboratorium nodig.
Conclusie
Het scala aan mogelijkheden om onderzoek te doen bij ingewikkelde transfusiecasuïstiek is breed. Het kiezen van de juiste techniek in een bepaalde situatie is belangrijk om geld en kostbare tijd te besparen. Daarom zijn in dit artikel de meest gangbare speciële technieken besproken aan de hand van hun eigenschappen, indicaties om ze in te zetten en de bijbehorende aandachtspunten.
Disclaimer
Belangenconflict: geen. Financiële ondersteuning: geen.
Summary
In this part of the series on complex transfusion diagnostics sophisticated techniques are being discussed that are commonly used in transfusion laboratories. This is done on the basis of their properties, indications to use them and pitfalls that are important to keep in mind when using these techniques. Choosing the right technique in a certain situation is important to save money and precious time. This publication can thus support the responsible blood transfusion specialist in making the right decisions when doing follow-up tests after a positive antibody screening and/or identification panel.